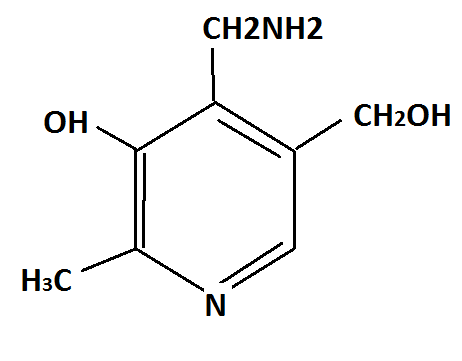
Sites acides basiques nucléophiles et éléctrophile
Discussions similaires
-
Par invitececc7402 dans le forum Chimie
Réponses: 0
Dernier message: 22/12/2013, 21h55
-
Par invite5f588e5b dans le forum Chimie
Réponses: 1
Dernier message: 07/01/2013, 13h03
-
Par invitef8f2bf9f dans le forum Chimie
Réponses: 1
Dernier message: 26/11/2012, 23h04
-
Par invited9fbbf30 dans le forum Chimie
Réponses: 1
Dernier message: 30/12/2009, 16h12
-
Par invite4da9b7a5 dans le forum Chimie
Réponses: 5
Dernier message: 06/03/2009, 19h52