Bonjour/bonsoir,
Suite à la lecture de mon cours de spectrométrie de masse et à plusieurs exercices, je n'arrive pas à comprendre ce qu'est exactement la masse monoisotopique. La définition donnée dans le cours est : "masse du premier pic du profil isotopique comportant la masse des isotope les plus stables".
Ainsi, lorsque dans l'exercice, on me pose la question "calculer la formule brute et la masse entière monoisotopique du composé attendu", je cherche à tout d'abord à identifier l'ion fragment (ou fragment neutre) qui correspond au premier pic du spectro (et donc le plus léger). Je détermine qu'il correspond à un groupe C5H6, de ce fait, je calcule 5x12+6= 66 u.
Pourtant, ce raisonnement est erroné, puisqu'en cherchant des exemples de calculs de masse monoisotopique, je trouve qu'en réalité, cela correspond à la masse de la molécule parent, et donc à l'addition de tous les atomes la composant.
Voilà ce que je n'arrive pas à comprendre : la masse monoisotopique est en fait quasiment égale à la masse nominale sauf qu'on utilise des masses d'atomes plus ou moins précises (ex pour le O : 15,99491 et 16 respectivement pour les 2 masses). Ainsi la masse du premier pic, correspondant à la masse du fragment le plus léger de la molécule parent, serait égale à la masse de celle-ci. De plus, puisque la molécule parent est déjà donnée dans l'énoncé, pourquoi utiliser le terme de "composé attendu" dans la question, s'il suffit juste de donner sa masse ? Enfin, les seules valeurs données à la fin de l'exercices sont les masses atomiques arrondies qu'on utilise uniquement pour la masse nominale (et nous n'avons pas à connaitre les valeurs exactes avec décimales).
Il y a certes un gros problème dans mon raisonnement, mais je n'arrive pas à comprendre où.
En vous remerciant par avance pour votre aide et votre patience,
Lyria.
-----




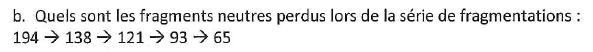
 .
.