Bonjour,
Comment sait-on l'enthalpie molaire d'un mélange à partir d'une table, voilà l’énoncé:
Un procédé industriel nécessite une solution (s) aqueuse d’éthanol diluée à 30 % massique en
éthanol à 40°C. On prépare cette solution à partir de 2 litres de solution aqueuse (a) à 80%
massique d’éthanol et 20°C que l’on dilue à l’eau pure (b) à 20°C.
On notera (1) l’éthanol et (2) l’eau.
tout d'abord on a calculé:
la masse de la solution a: 1,67kg
La masse de la solution b: 2,78kg
La masse de la solution s: 4,45kg
Les volumes de chaque solution sont ainsi:
Va: 2Litres
Vb: 2,79L
Vs: 4,66 L
on déduit alors qu'il y a eu contraction du volume qui vaut 0,12L
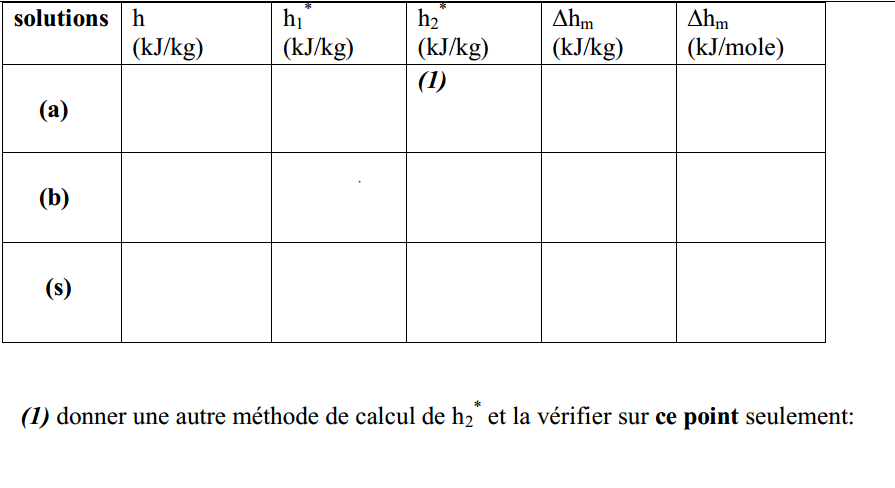
Ensuite nous devons établir un bilan d'énergie (Ha+Hb=Hs) (Q=0)
ma*ha+mb*hb=ms*hs
Aves:
ha= W1a*h1° + W2a*h2° + Delta(hamél)
hb= W2b*h2° (Car c'est un corps pur)
hs= W1s*h1° +W2s*h2 + Delta Hsmél
Je suis arrivée à ce stade ( Si j'ai commis une erreur dites le moi svp)
Et puis on nous demande de chercher h, h1°, h2° et Delta Hmél dans chaque solution à l'aide d'une table des solutions aqueuses d'éthanol je le mets en jointure!
j'espere bien expliqué la situation, Merci d'avance les chimistes!!
-----