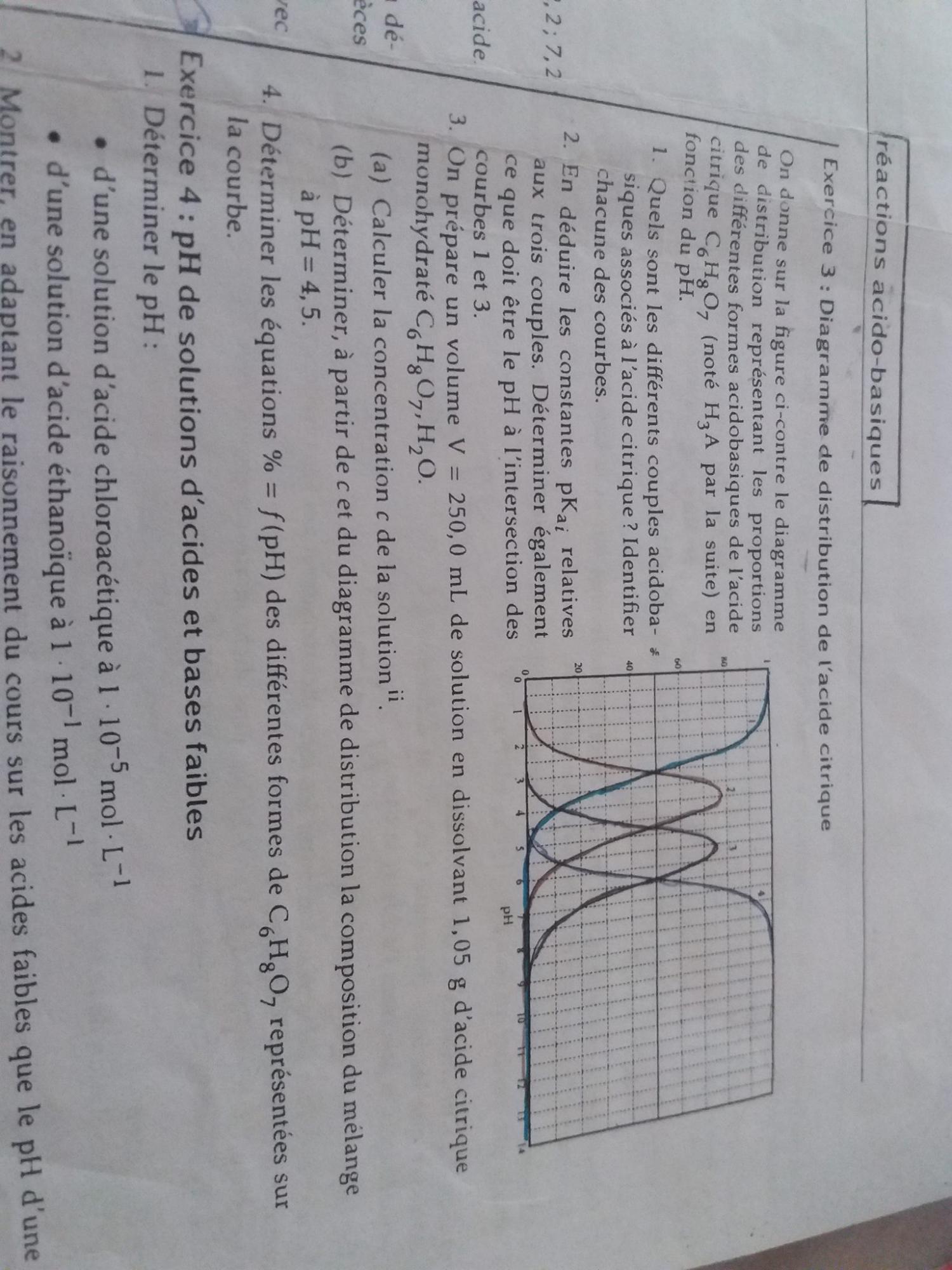
Dans une solution contenant C6H8O7 de ph a l équilibre égale x ( x un nombre compris entre 0 et 14 ) on a le pourcentage de chaque élément est ... ( on le deduit par projection sur les courbes )
-----
Dans une solution contenant C6H8O7 de ph a l équilibre égale x ( x un nombre compris entre 0 et 14 ) on a le pourcentage de chaque élément est ... ( on le deduit par projection sur les courbes )


Salut j ai mal à lire ce genre des diagrammes (voir image)
Ces diagrammes se lit de la façon suivante :
Dans une solution contenant C6H8O7 de ph a l équilibre égale x ( x un nombre compris entre 0 et 14 ) on a le pourcentage de chaque élément est ... ( on le deduit par projection sur les courbes )

Bonjour,
Si tu réalises une solution quelconque d'acide citrique, tu peux ajuster le pH cette solution à n'importe quelle valeur entre 0 et 14 en ajoutant des quantités adéquates d'acide fort comme HCl, ou de base forte comme NaOH. Une fois que tu as atteint un des pH reporté en abscisse sur le diagramme donné, tu peux connaître le pourcentage d'acide qui se trouve sous chacune des trois formes de cet acide. Il y a d'abord la forme d'acide non chargé contenant 3 H, d'ions ayant perdu 1 H et acquis 1 charge négative, d'ions ayant perdu 2 H et ayant acquis 2 charges négatives, et d'ions ayant perdu tous les lions H et possédant 3 charges négatives. Quand on fait croître le pH de 0 à 4, on voit que la forme neutre devient de moins en moins importante, pour devenir inexistante à pH 5. Mais dès que cette forme non chargée diminue, les autres prennent de l'importance.
A pH 2, la courbe bleue montre qu'il y a encore 92% de l'acide qui est sous forme moléculaire C6H8O6 , et 8% sous forme d'ion C6H7O6- (début de la courbe en cloche).
A pH 3.5, la courbe bleue montre qu'il n'y a plus que 26% d'acide citrique sous forme C6H8O6. Par contre la 2ème courbe, en noir, montre qu'il y a à peu près 70% sous forme C6H7O6-.
Mais on voit aussi qu'à ce pH 3.5, la troisième courbe, en noir, commence à être significative. Et 4% de l'acide citrique est sous forme C6H6O62-.
Tu m'as suivi ?

oui j'ai suivi mais l'ajout du hcl ne va pas influencer sur la solution ? par exemple il se peut qu'une base se reagit avec l'acide fort H3O+

Dans ce genre d'exercice on ne cherche pas à savoir comment on fixe le pH de la solution. On regarde simplement le pourcentage de chaque espèce de l'acide ( triacide) pour chaque valeur du pH imposé à la solution .

Bonjour,
Bien sûr que l'adjonction de HCl modifie la nature et la composition de la solution. L'adjonction de base aussi, bien entendu. Mais ce n'est pas notre propos. Quel que soit la nature de l'acide ou de la base ajoutée, et la quantité utilisée, on finit par obtenir une certaine valeur de pH. C'est tout ce qui importe. Et à cette valeur de pH, on cherche à savoir si l'acide citrique existe vraiment en solution, ou si il est transformé en l'un de ses ions plus ou moins déshydrogénés, et en quelle proportion. Et cette proportion ne dépend pas de l'origine de la solution. La nature et la concentration des ions présents dans la solution finale ne dépend pas du fait qu'on est parti d'une solution d'acide citrique ou de citrate, et qu'on y ait ajouté une base forte ou un acide fort. Elle ne dépend que du pH.

Autre manière de voir les choses, plus mathématiquement.
Rappelons l'équation de dissociation et mettons-là sous une forme adaptée :
Ce que la deuxième forme nous dit, c'est que lorsqu'on fixe le pH (membre de droite) alors, quoi qu'on fasse, le rapport [HAc]/[Ac-] est fixé.
C'est justement ce que le graphique présente, ce rapport comme une fonction du pH.
Si on rajoute de l'acide, le pH de la solution va varier mais à ce nouveau pH, il y aura simplement un autre rapport [HAc]/[Ac-].
Autre manière de voir les choses, si on a 2 solutions différentes avec des concentrations totale en "acétate" (HAc + Ac-) différentes mais dans les mêmes proportions, alors ces deux solutions auront le même pH.
Exemple :
- solution 1 : [HAc] = 0.1, [Ac-] = 0.01 ---> [H3O+] = 10. Ka
- solution 2 : [HAc] = 0.2, [Ac-] = 0.02 ---> [H3O+] = 10. Ka

