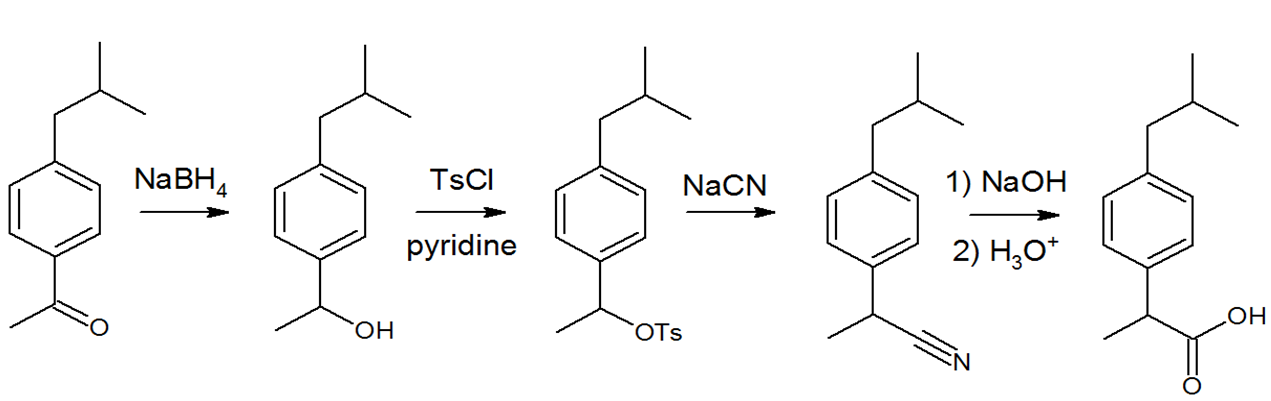
Bonjour à tous,
Alors voilà mon problème, dans le cadre d'un projet de recherche je dois réaliser une synthèse incluant la transformation d'un groupement hydroxyle en tosylate à l'aide de TsCl. Cependant je n'ai aucune idée de comment réaliser mon protocole de synthèse... Voilà si vous pouviez m'aider ça serait génial !
Merci à tous !
-----