Bonjour, j'ai une petite question. On me demande de trouver le mécanisme (ou du moins la réaction) pour passer du composé 8 au composé 2. Le palladium peut faire penser à une hydrogénation mais il n'y a pas de dihydrogène et je ne vois pas comment peut agir le carbonate ? De même le réactif suivant peut faire penser à une réaction de Wittig sur un alcool que le DMSO aurait pu oxyder mais bon je ne vois pas comment former un alcool ici... Fin bref je ne vois pas trop quelle suite de réaction serait plausible si quelqu'un pouvait m'éclairer ...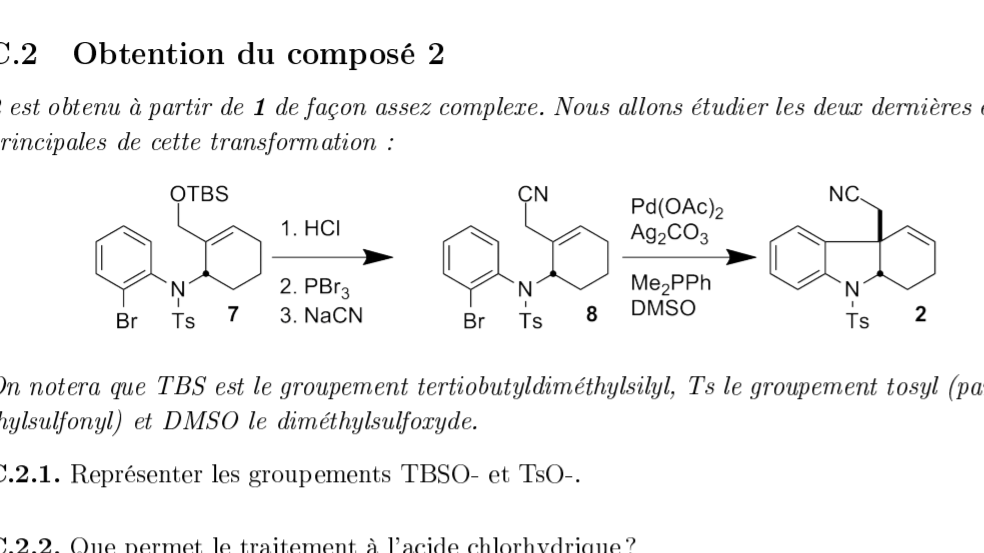
-----


