Hello
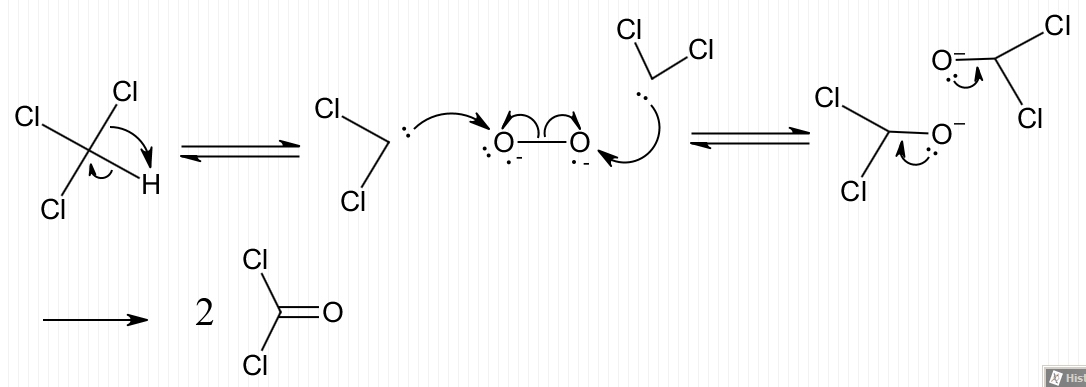
Pour la fac (en pharmacie) j'ai cette réaction dont je ne connais pas le mécanisme :
2CHCl3 + CrO3 + O2 → 2COCl2 + CrO2Cl2 + H2O
Est-ce que vous en avez une idée ? Elle se fait entre 150 et 190 °C.
J'hésite à inclure un carbène (carbone divalent, Cl-C:-Cl) en intermédiaire de réaction.
L'oxygène a-t-il un mécanisme radicalaire ?
merci bcp
-----