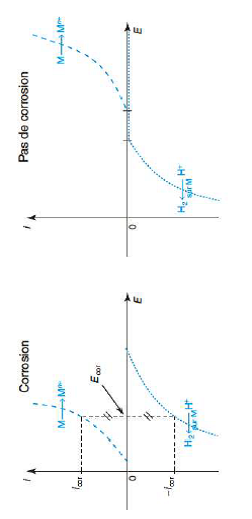
Bonsoir, dans ces courbes il y a un point que je n'arrive pas à comprendre , il est dit dans la courbe de droite qu'il n'y a pas de corrosion et pourtant le métal se transforme en ions métalliques …. Est-ce que vous pouvez s'il vous plait m'expliquer comment pouvons-nous à partir des courbes intensité-potentiels dire s'il y a phénomène de corrosion ou non ?
Merci.
Pièce jointe supprimée
-----