Bonjour !
Je ne parviens pas à comprendre pourquoi l'atome d'oxygène O(1) ne possède pas de doublet non liant situé dans une orbitale p. Un de ses doublets semble pourtant délocalisable...
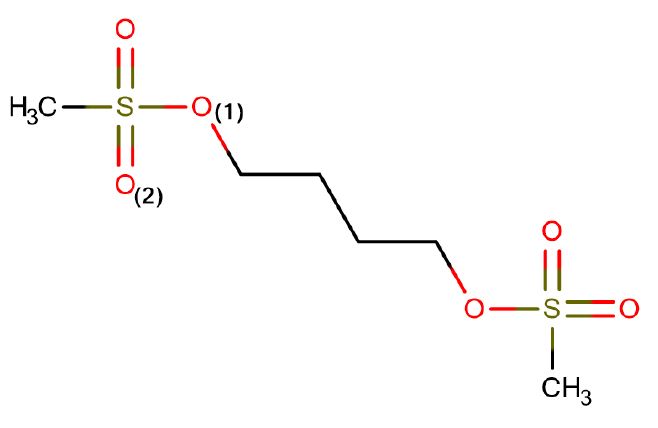
-----
Bonjour !
Je ne parviens pas à comprendre pourquoi l'atome d'oxygène O(1) ne possède pas de doublet non liant situé dans une orbitale p. Un de ses doublets semble pourtant délocalisable...


Bonsoir,
L'atome d'oxygène (1) est lié par des liaisons sigma l'aide d'orbitale hybrides de type sp3. Il n'y a pas (ou plus) d'orbitales p autour de cet atome.

Merci pour votre réponse. Je pense avoir bien compris tout ce qui concerne les orbitales moléculaires mais ma question aurait du être pourquoi un des doublets non liants de l'atome d'oxygène n'est pas délocalisable malgré l'alternance de liaisons pi-sigma-DNL.
Je suis bien d'accord que si le DNL n'est pas délocalisable, alors il se trouve dans une orbitale sp3.
Est-ce parce que l'atome d'oxygène ne peut porter de charge positive ?

Bonsoir,
Qu'est-ce que tu appelles DNL ?

Excusez-moi, c'est pour doublet non liant.

Bonsoir,
Qu'est-ce qui te gène avec la formule imprimée ? Pourquoi voudrais-tu délocaliser le doublet non liant de l'oxygène ? Pour faire quoi ? Pour faire apparaître une charge négative sur l'atome de Carbone ? Tu sais bien qu'il n'y a aucune raison de le faire.

La question demandée était : L'atome d'oxygène possède t-il un doublet non liant situé dans une orbitale p ?
Pour répondre à cette question, je détermine l'hybridation de l'atome d'oxygène : AL2E2 donc atome hybridé sp3 (et doublet non liant hybridé sp3) si les doublets non liants ne sont pas délocalisables ou bien atome hybridé sp2 (et doublet non liant dans une orbitale p) si un des doublets est délocalisable.
Je pensais qu'un des doublets non liant était délocalisable mais il semblerait que non d'où ma question...
Dernière modification par coco1602 ; 09/10/2018 à 23h08.

Bonjour,
Il faut être conscient que le modèle d'hybridation atomique sp3 n'est qu'un modèle, qui essaye de prédire le mieux possible la réalité, mais qui a des zones où il échoue complétement. Un autre modèle est celui des orbitales moléculaires (LCAO), qui est souvent meilleur, mais pas toujours
Dans le cas de l'oxygène lié à 2 autres atomes, les deux modèles donnent des prédictions contradictoires : dans le modèle des liaisons de valence (type sp3), les doublets non liants de l'oxygène devraient être identiques et dans des positions symétriques par rapport au plan des atomes.
Avec le modèle LCAO, une des deux orbitales est dans le plan, ce qui ressemblerait en effet à du sp2, et l'autre étant orthogonale aux autres n'interagit pas, et restera donc p (délocalisable dans votre modèle).
La réalité, telle qu'on peut la retrouver par des calculs de chimie quantique numérique, est en fait entre les deux*, et certains livres n'hésitent pas à parler de sp2,5, sp2,1, etc. (ce que je vous déconseille fortement, car cela peut donner des boutons à certains profs : alignez-vous sur ce qu'écrit le votre)
Vous retrouverez cette même difficulté dans certains composés cycliques contenant de l'azote.
*ou parfois ni l'un ni l'autre : par exemple, les deux modèles échouent à prédire correctement l'angle formé par les liaisons hydrogène sur l'oxygène, car ces liaisons hydrogène ont une forte composante électrostatique, que les modèles ne prennent pas en compte
Dernière modification par Resartus ; 10/10/2018 à 08h05.
Why, sometimes I've believed as many as six impossible things before breakfast

Je vous remercie pour vos explications. Je suis bien conscient que la réalité est toujours plus complexe que les différents modèles qu'on nous propose.
Si j'ai bien compris, le doublet non liant de l'oxygène est bien delocalisable.
Cependant le fait qu'il ne soit pas dans une orbitale me perturbe toujours...
Je vous mets les éléments de correction que j'ai, vous comprendrez peut être mieux que moi :
B. Un doublet non-liant de l'oxygène O(1) est situé dans une orbitale p.
FAUX. O(1) est aussi tétraédrigrue selon VSEPR. On pourrait croire qu'il est hybridé sp2 et qu'il serait possible de faire de la conjugaison avec une liaison pi S=O. Or ce n'est pas possible car le soufre est tétraédrique, donc la liaison S=O(2) n'est pas dans le meme plan que la liaison S-O(1) : géométriquement, on ne peut pas faire de recouvrement des orbitales p et en plus le soufire n'en a pas.

Le problème de cette discussion, coco1602 est que (comme souvent), tu ne nous donnes pas toute l'information.
"Nous" t'avons répondu en ne connaissant pas ton niveau en chimie, ni dans quel cadre tu posais la question.
Maintenant que c'est plus clair, la réponse (à ton niveau) est effectivement "non". Pour avoir délocalisation, il faut la présence d'orbitales "p" voisines et doivent de surcroit être dans le même plan. Or ici, l'oxygène(1) ne dispose pas d'orbitales p du tout puisque ses 3 orbitales p sont fusionnées (avec la s) pour former l'hybride sp3. Pour avoir une orbitale p libre, il faut être dans la configuration sp2 (1s + 2p) puisque alors il reste une orbitale p disponible.
Exemple d'oxygène hybridé sp2 : https://encrypted-tbn0.gstatic.com/i...g2wBjteg5RBrMe

