Bonsoir
Je me permets de publier cet exercice venant d'un devoir que je dois faire et cela concerne les piles et l'oxydoréduction. (Je suis en "terminale" en Belgique)
En fait j'ai plusieurs schémas et je dois dire si la pile est fonctionnelle ou non et expliquer pourquoi. J'ai réussi à me débrouiller pour tous sauf pour un où je ne suis pas certaine de la réponse. J'espère donc que vous pourrez m'apporter des précisions
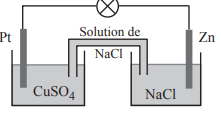
Donc voici le schéma, et je ne sais pas si la pile est fonctionnelle ou non. Ne faut il pas que les plaques soient faites des composés qui vont se réduire/s'oxyder ? Est ce que la seule présence de ces composés dans les solutions suffit pour que la pile fonctionne? (Je précise que la seule configuration de pile que j'ai vu de ce type jusqu'à présent était avec des plaques de cuivre et de zinc et des solutions de CuSO4 et de ZnSO4, d'où cette interrogation...)
En espérant que ce soit suffisamment clair.. Merci beaucoup d'avance
-----



