Bonsoir!
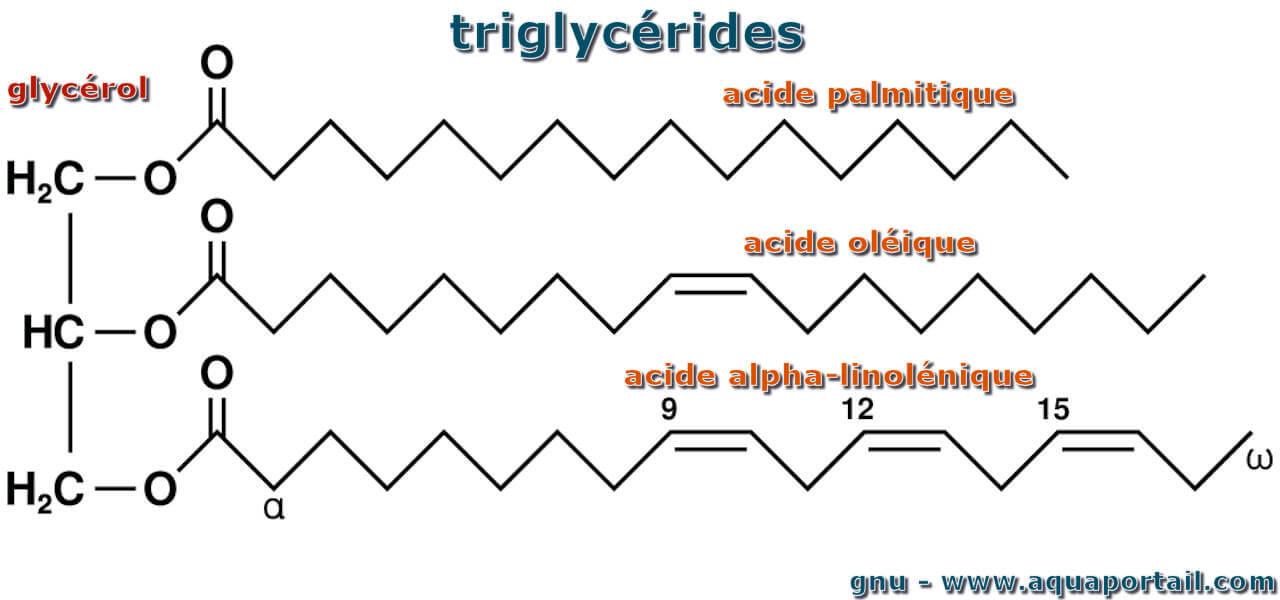
J'aurai une question à vous posez. Cela concerne précisément les liaisons intermoléculaires mais je vais commencer par le début. Je fais un TPE sur l'oeuf et je cherche des substituts de celui-ci. Nous nous sommes donc renseigner sur le pouvoir émulsifiant qui est surtout dû à cette molécule, la lécithine un mélange de lipides neutres (en bleu et vert) (souvent de la triglycéride), de lipides polaires (en rouge) et de glycérol (en noir).
le.jpg
(Texte de mon TPE) Cette molécule est un tensioactif. Elle est donc amphipolaire, c'est-à-dire qu'elles présentent deux parties de polarité différente, l'une lipophile (qui retient les matières grasses) et apolaire, l'autre hydrophile (miscible dans l'eau) et polaire. La polarité est une caractéristique décrivant la répartition des charges négatives et positives dans une molécule. Plus les charges sont réparties de façon asymétrique, plus une liaison ou molécule sera polaire. Les molécules polaires ont une affinité avec les composés polaires tandis qu'elles en ont très peu voire pas du tout avec les composés apolaire. L'eau est l'une des molécules les plus polaires, les composés apolaires sont donc qualifiés d'hydrophobes et les composés polaires d'hydrophiles.
hy.png
J'ai comme substitut, un additif qui sert d'émulsifiant : l'orthophosphate de sodium qui a pour formule :
Disodium_hydrogen_phosphate.png
C'est une molécule apolaire, et elle n'a pas ses "pattes" comme la lécithine. J'ai donc émis l'hypothèse que cet orthophosphate devait se "rattacher" à de la triglycéride ou au moins à de la glycéride. J'ai donc étudier la cohésion des cristaux moléculaires avec la loi de Van der Waals et les liaisons d'hydrogène.
Voici la glycéride avec au bout de la glycérol des hydrogènes :
A ce moment là, un des oxygènes "partirait" avec le glycérole comme on peut le voir avec la formule de la lecithine en haut et j'obtiendrais une molécule amphiphile....
Tout est fondé sur des hypothèses donc si vous pouviez seuleument me confirmer ce qui est dit, ce serait génial. Sinon, mon but ultime, si toutes mes hypothèses sont vraies, serait de savoir qu'elle type de cohésion ai-je là.
Merci d'avance
Et en tout cas, merci d'avoir lu
Bonne soirée
-----