j'ai une question .
est ce qu'on peut dire que lorsque le PH augmente le nombre d'oxydation augmente ?
-----

j'ai une question .
est ce qu'on peut dire que lorsque le PH augmente le nombre d'oxydation augmente ?

Bonjour,
Je ne vois pas le rapport, pourriez-vous préciser la question ? Peut-être avec un exemple ?

Bonjour
Un déplacement vers la droite dans le diagramme de Pourbaix correspont à une augmentation de pH ; cela ne modifie pas la stabilité du nombre d'oxydation. On passe par exemple d'un acide à la base conjuguée ou on passe d'un ion métallique à son hydroxyde.
En revanche, plus on est haut dans le diagramme, (valeur de E élevée) plus le nombre d’oxydation stable est grand. Par exemple, pour l'élément fer en milieu acide, en s'élevant dans le diagramme, on passe de Fe(0) à Fe(II) stable puis à Fe(III) stable.

Bonjour ,merci pour votre réponse
Réaction tube 1+2 : réaction entra KMnO4 / Na2C2O4
(MnO4 - + 5 e- + 8 H+ → Mn2+ + 4 H2O )*2 demi-réaction de réduction de l’ion permanganate MnO4 -, un oxydant, en ion Mn2+, son réducteur conjugué.
L'acide oxalique a pour formule brute H2C2O4. :
(5 C2O4= + 2 MnO4- + 16 H+ → 10 CO2 + 2 Mn2+ + 8 H2O)*5 ( demi-réaction ½ équation d’oxydation )
Bilan : 2 MnO4- + 5 C2O42- + 16H+ 10 CO2 + 2 Mn2+ + 8 H2O
no(MnO4-)=n(Mn)+4n(O)=-1 ‘ou n(Mn)=-1-4*-2=-1+8=+ VII no(Mn)=+2 réduction
Deux tubes identiques portés à température différentes : pour montrer l'influence de la température sur la vitesse des réactions. Plus la température est élevée plus la réaction est rapide et inversement.
Réaction tube 3 : milieu neutre
MnO4- + 5e- + 4H2O => Mn(OH)2 + 6OH-
No(MnO4)-= n(Mn)+4n(O)= - I no Mn(OH)2=n(Mn)+2n(O) + 2n(H)=0 d’où n(Mn)=0-2*n(O) -2*n(H)=-2*-2 -(2*1)= 4-2=+II (Oxydation)
4-ème tube
2MnO4- (aq)+C2O42- (aq)+4OH- (aq)--> 2MnO42- (aq) +2CO3 2-(aq)+2H2O
No(MnO4)-= n(Mn)+4n(O)=-1 no(MnO42-)=n(Mn)+4*n(O)=-2 d’où n(Mn)=-2+8= +VI (oxydation)
à chaque fois que le PH augmente j'ai remarqué que le nombre d'oxydation de Mn augmente

le sujet :
• Dans quatre tubes à essai, mettre environ 10 gouttes de solution MnO4
- à 0,01 mol.L-1
.
• Placer 3 des tubes dans un bain marie porté à ébullition et le dernier dans un bain-marie de glace.
o Dans le premier tube (dans la glace), ajouter environ 1 mL de H2SO4 0,1 mol.L-1
. Puis verser 1
mL de solution d’oxalate de sodium 0,2 mol.L-1
.
o Dans le deuxième tube, ajouter environ 1 mL de H2SO4 0,1 mol.L-1
. Puis verser 1 mL de solution
d’oxalate de sodium 0,2 mol.L-1
.
BMox BMred
Chimie expérimentale pour la biologie Année universitaire 2019-2020
28
o Dans le troisième tube, ajouter environ 1 mL d’eau distillée. Puis verser 1 mL de solution
d’oxalate de sodium 0,2 mol.L-1
.
o Dans le quatrième tube, ajouter environ 1 mL de soude NaOH 10 mol.L-1 (attention : soude
très concentrée, gants et lunettes obligatoires). Puis verser 1 mL de solution d’oxalate de
sodium 0,2 mol.L-1
. Laisser réagir jusqu’au changement total de la couleur de la solution.
o Ajouter quelques mL de H2SO4 1 mol.L-1 dans le tube 4, après la décoloration du tube soit
totale.

Bonjour.
Il faut revoir les couples redox "MnO42-" n'existe pas. Le permanganate fait parti du couple MnO4-/Mn2+.
Comment détermines-tu les équations des réactions ?
De plus le nombre d'oxydation se réfère à un élément, parler du nombre d'oxydation de MnO4- "= no(MnO4-)" n'a pas de sens.
Ce n'est pas le pH qui impose le degré d'oxydation de l'espèce. On pourra retrouver des formes différentes selon le pH : précipitation d'hydroxydes en milieu basique ou forme ionique en milieu acide mais le nombre d'oxydation reste inchangé.
Dernière modification par Kemiste ; 03/05/2020 à 11h56.

il existe sous forme aqueuse , je viens de vérifier sur le diagramme de pourbaix de Mn . j'ai déterminé les réactions à partir de la couleur des produits formés pour chaque réaction

Bonjour,
Si on superpose le couple de l'acide oxalique sur le diagramme du Mn, la courbe reste dans la zone de stabilité de Mn(+II).
Comment avez-vous obtenu votre équation ?

j'ai pas bien compris votre question

en plus c'est le prof qui nous a donné les équations car on a pas fait le cours à cause de confinement j'ai juste équilibré les equations et j'ai calculé le nombre d'oxydation de Mn dans chaque réaction

Pour répondre à la question initiale, si MnO4- donne Mn(+II) à faible pH et MnO42- à fort pH, cela vient (viendrait) du fait que la limite Mn(+VII) / Mn(+II) décroit plus vite que la limite C2H2O4 / CO2, donc pas une règle générale.
Diagramme déformé pour illustration :
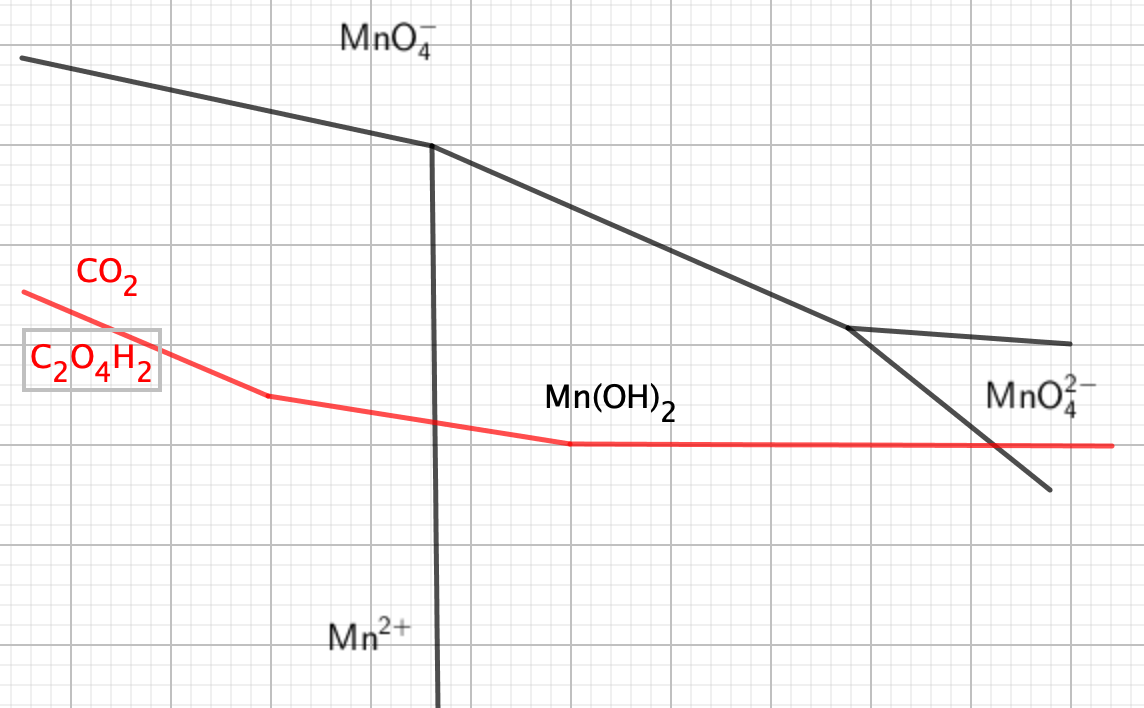

je n'arrive pas à voir l'image que vous avez envoyé, mais est ce que vous pouvez m'expliquer votre dernière phrase s'il vous plait ?

La limite Mn(+VII)/Mn(+II) décroit plus vite que celle de C2O4H2/CO2, elles vont se croiser, donc cette réaction ne sera plus favorisée, et une autre prendra le relais avec obligatoirement un Mn réducteur de no plus élevé, puisque no augmente quand on monte dans un diagramme E-pH.
Mais je répète cela dépend de la pente de vos courbes. On pourrait imaginer qu'au contraire la courbe avec le couple de C2O4H2 plonge et croise un autre couple de l'oxydant et là on aurait un Mn réducteur de no plus bas.

Merci pour votre réponse mais on a pas vu ça en cours , mais j'ai bien compris ce que vous avez expliqué . juste je peux dire simplement avec ce que j'ai trouvé comme résultats que le nombre d'oxydation de Mn augmente quand on monte dans le diagramme E-PH ?

La règle énoncée est simplement la règle classique "oxydant le plus fort sur réducteur le plus fort" ou "règle du gamma" adaptée au diagramme potentiel-pH.
Pour la conclusion, quelle est la question posée suite à la description des quatre expériences ?

c'est de dire qu'est ce qu'il s'est passer en utilisant le diagramme de pourbaix de Mn . pour cela on peut dire que no de Mn augmente quand on monte dans un diagramme E-pH?on peut dire aussi lorsque le PH augmente le pouvoir réducteur de Mn augmente ?

Le problème est que j'ai du mal avec vos équations :
Je placerai le point représentatif de l'oxalate sur le diagramme
1- milieu acide : point dans la zone Mn2+, donc OK pour la réaction
2- milieu légèrement basique (eau distillée + oxalate), Mn(OH)2 un peu limite, mais disons OK
3- très nettement basique et là je ne vois pas vraiment
"on peut dire que no de Mn augmente quand on monte dans un diagramme E-pH ?"
Cela est une généralité sur les diagrammes E-pH.
"on peut dire aussi lorsque le pH augmente le pouvoir réducteur de Mn augmente ?"
éventuellement (on voit que la limite Mn / Mn(OH)2 descend quand pH augmente) mais c'est sans lien avec vos expériences.

l'équation 3 est un donné , j'ai pas compris c'est quoi le problème dans cette équation. sinon j'ai dit que en fonction de PH on obtient des formes différentes , on peut déterminer à l'aide de de diagramme pourbaix que lorsque le pH augmente le pouvoir réducteur de Mn augmente .


