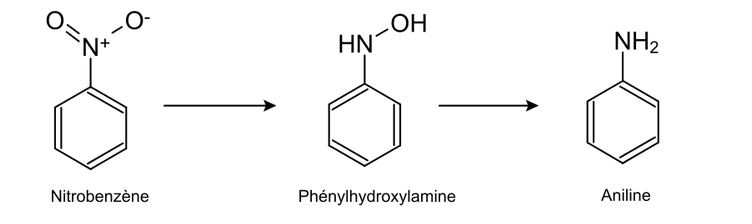
Bonjour, sur mon bouquin, je viens de termine le chapitre s’attachant à l’hydrogénation via l’addition de H2. Ainsi, une liaison double se voit éclipser par deux nouvelles liaisons à deux hydrogènes. Cependant en me baladant sur la toile, à mes grands yeux d’étonnement, je vois qu’il est possible de réduire "les groupes nitro, imine et oxime par hydrogénation" (source Wikipédia sur la page d'hydrogénation). Or, pour ce qui est du groupe nitro et oxime, l’atome d'oxygène « disparait » par exemple on réduit un groupe nitro (NO2) en amine (NH2). Je n’ai pas vu ce cas dans mon livre, et malgré que je me creuse la tête, je n’arrive pas à comprendre. Quelqu’un peut-il m’expliquer comment peut-on réduire par hydrogénation les groupes nitro et oxime ? Enfin, comment le O double liaison dans le premier cas "disparait", et celui en simple liaison dans le deuxième cas ?
Merci à vous !
-----