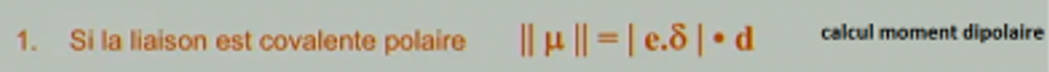Bonjour,
Il y a une partie de mon cours de chimie qui est assez floue pour moi, pouvez-vous m’éclairer s’il vous plait ?
Je ne saisis pas bien ce qu’est le pourcentage de caractère ionique (% i) (ou du caractère ionique partiel) d’une liaison covalente. Si j’ai bien compris, ça nous indique à quel point la liaison est polarisée. C’est ça ?
Mais alors, quel est la différence entre ce pourcentage et le moment dipolaire ? Entre ce pourcentage et le moment ionique.
A quoi correspond µionique ? (µ indice ionique) ? A quoi correspond µréel ? (µ indice réel)
Pour calculer le moment dipolaire, j’ai cette formule dans mon cours :
d = distance entre les deux atomes liés (l’unité est bien en m ?)
δe = charge partielle d'un atome lié. Comment trouve t-on ce δe ?
Merci de votre attention, et désolé de vous avoir harcelé de questions
Bon dimanche !
PS : je voudrais savoir quelles sont les personnes qui vont me répondre ? (des étudiants, des professeurs, des ingénieurs… ?)
-----