Bonjour,
Je voudrais avoir votre avis sur l'exercice suivant s'il vous plait.
Le corrigé dit que la pente vaut ak, comme le sait t'on ?
Je ne comprends pas également pourquoi dans l'expérience 2, k est exprimée en s^-1, et dans l'expérience 1 en mol/L/s ?
Une constante est censée etre.. constante ?
EDIT : est ce que je peux dire que la réaction est élémentaire du simple fait que c'est une expression de type A+B --> C ? (c'est bien une réaction élémentaire, mais que pensez vous de la justification ? )
Merci de votre attention
1 pièce jointe :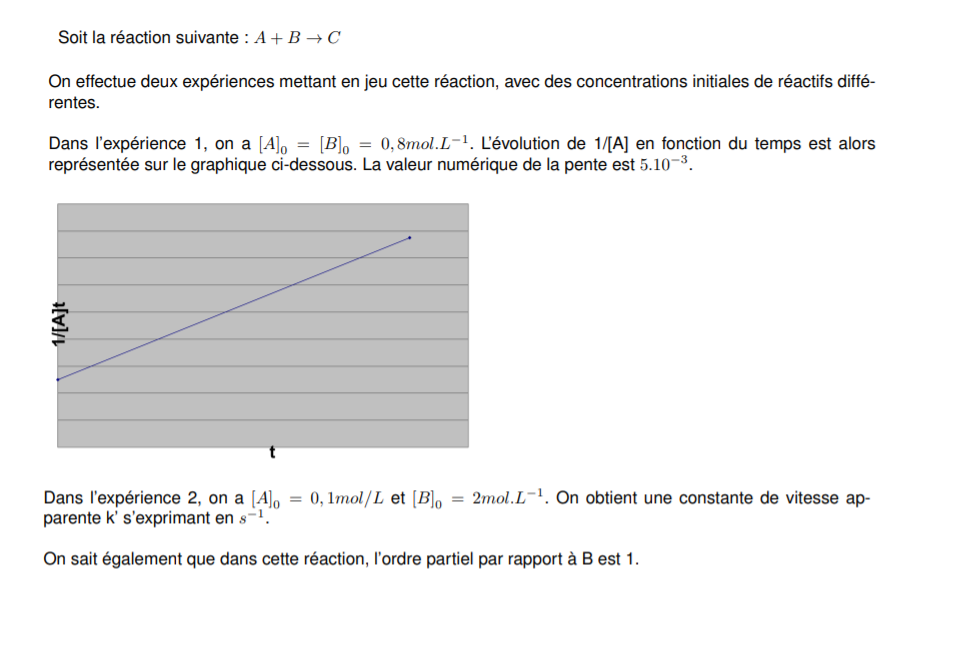
-----



