Bonjour à tous,
je suis en écriture de CR de TP sur l'électrolyse de l'eau en solution électrolytique d'H2SO4 1M avec 3 électrodes
ET en Platine, ERef au sulfate mercureux avec (E= 0658 V) et CE en platine aussi
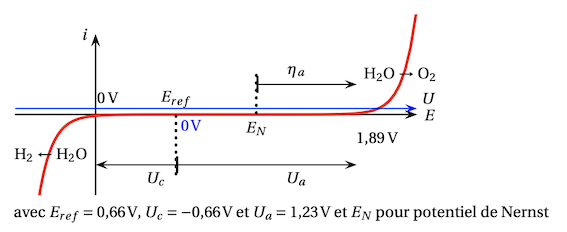
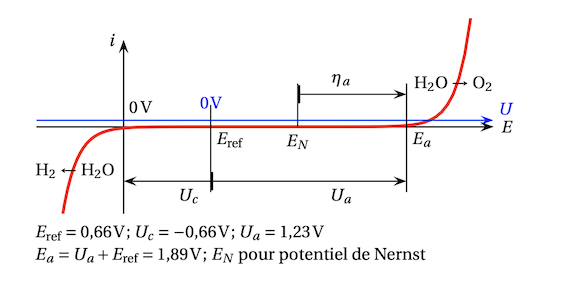
On a tracé les graphes i = f(E)
on doit trouvé le domaine de l'électroactivité de l'eai et les surtensions anodiques et cathodiques ainsi que si le système est lent ou rapide selon l'électrode.
J'ai un souci car je n'arrive pas à être sûre de mon domaine d'électroactivité. A quel moment je peux, sur le graphe être sûre. Je le bloque à quel valeur de tension aux extrêmités?
à i = 0 j'ai à la cathode la réduction de H+ en H2
un courant apparait à E = -0.66V
à l'anode, j'ai l'oxydation de H2O en O2
et là je n'arrive pas à récupérer E = 1,70 V que je lis partout... je n'obtiens que E = 1,23 V soit E° du couple correspondant et je n'aurais donc pas de surtension anodique ...
Là ça m'étonne!!! je pourrais décaler à un peu plus mais pas trop quand même
Le prof n'a pas arrêté de nous dire attention, il faut calculer le pH de l'électrolyte
je comprends bien maintenant pourquoi, il fait réagir différemment les électrons selon la valeur de pH...
Je voudrais savoir aussi à quoi me sert E = 0.658V de ERef ? c'est la valeur de potentiel pour faire la différence avec Eeq lors du calcul de la surtension?
Merci d'avance
-----