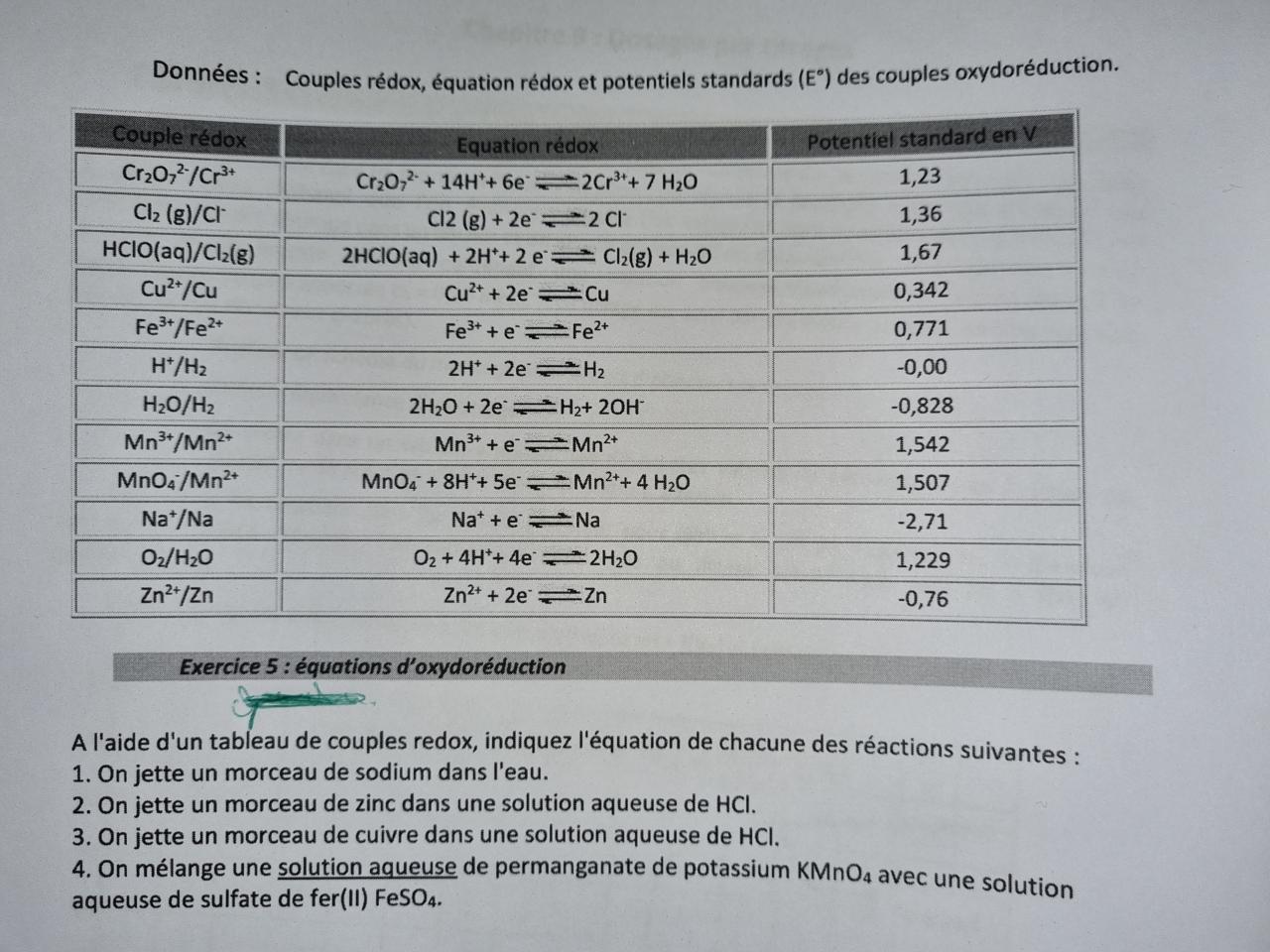
Bonjour à tous,
Je viens vers vous parce que je suis pour ainsi dire un peu paumé sur un exo. Je suis en classe de mise à niveau scientifique, aucune difficultés rencontrée jusqu'à maintenant mais j'ai l'impression d'être tombé sur un os, l'os en question :
J'ai réussi tous les exos du chapitre mais celui là, j'ai beau le tourner dans tous les sens, je bloque.
Sur le petit 1. On est d'accord que Na et H2O sont tous les deux réducteurs ? Comment appliquer la règle du gamma dans ce cas ?
Sur toutes les trois autres, j'ai juste l'impression qu'il me manque des données. Rien dans le cours non plus pour aider. Première question, peut être idiote, est-ce que l'exo est réalisable en l'état ?
Sachant, comme je le disais, qu'il n'y a rien dans mon cours qui fasse écho à des situation ou les couples redox ne sont pas donnés clairement.
Est-ce qu'HCl fait partie d'un couple redox ? Ou alors on prend les couples de H+ et Cl- ? Les deux couples ? Un seul des deux ?
Sur la dernière question, pareil. Rien dans le tableau sur SO4 ou K.
Est-ce que c'est une affaire d'ions spectateurs ? Si oui, comment savoir les quels sont spectateurs ?
Voilà, en espérant n'avoir pas été trop brouillon. Déso pour le dérangement et merci d'avance à ceux qui répondront.
-----