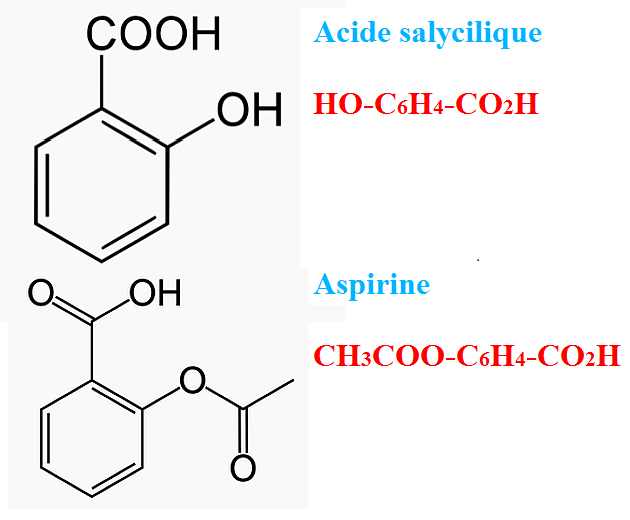
Bonjour,
Je dois bientôt rendre mon tfe et j'ai un problème. Je ne comprends pas très bien la réaction chimique pour faire de l'aspirine...
Voilà ce que j'écris : il s’agit d’une réaction d’estérification. Une réaction d’estérification est une réaction entre un alcool (R2-OH) et un acide carboxylique (R1-COOH). Le résultat de cette réaction va donner un ester (R1-COO-R2) et de l’eau(H₂O).
Autrement dit, l’estérification de la fonction hydroxyle de l’acide salicylique (C₇H₆O₃) avec l’anhydride acétique (C4H6O3) dans un milieu acide donne de l’acide acétylsalicylique (C₉H₈O₄) et de l’acide acétique (CH₃COOH).
C₇H₆O₃ + C4H7O3 → C₉H₈O₄+ CH₃COOH
Ce que je ne comprends pas c'est que j'ai un H qui disparaît? (Serait-ce lié à une double liaison?) Et selon la définition de l'estérification, il y aurait apparition d'eau... (comment est-ce possible?)
Merci d'avance pour vos réponses
-----