Bonjour à tous .
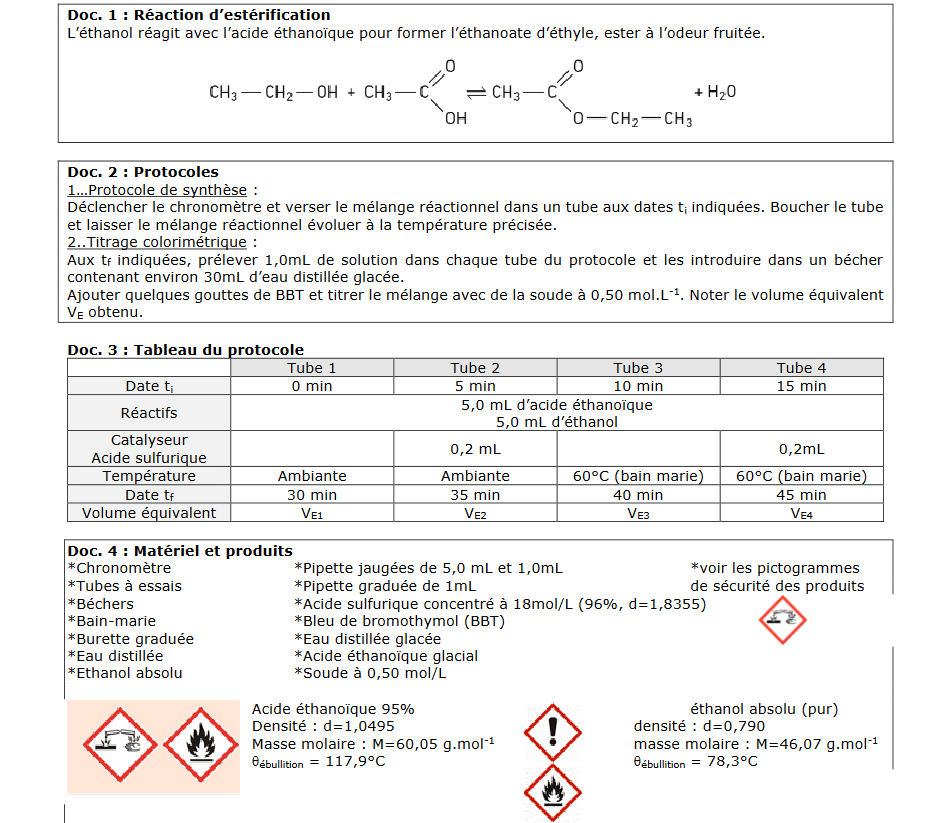
dans une réaction d'estérification , entre éthanol et acide éthanoique on titre après un certain temps avec de la soude . de l'acide sulfurique avait également était rajouté comme catalyseur .
Mon professeur m'a cependant fait remarquer que lorsque l'on veut titrer une espèce acide par une base , il fallait titrer tous les acides en même temps , ce qui parait logique , mais dans ce cas , comment se passe le protocole ? On a ajouté du BBT pour observer le passage d'un état à l'autre , mais comment peut on trouver séparément les deux volumes équivalents ? N'observerons nous pas uniquement le volume équivalent de l’espèce ayant la plus forte concentration ? De plus quel serait l’intérêt de titrer un catalyseur , sa quantité reste constante non ?
Merci d'avance
-----