Bonjour, est ce quelqu’un pourrait m’aider à résoudre cet exercice s’il vous plaît.
Je ne sais pas comment avec trois espèces je peux calculer le pH en utilisant la méthode de la réaction prépondérante.
Je vous remercie d’avance
-----

Bonjour, est ce quelqu’un pourrait m’aider à résoudre cet exercice s’il vous plaît.
Je ne sais pas comment avec trois espèces je peux calculer le pH en utilisant la méthode de la réaction prépondérante.
Je vous remercie d’avance

Bonjour,
Qu'avez-vous trouvé comme RP dans les deux cas.
De même quelle est la solution finale (après RP).

Le problème étant que je ne sais pas comment m’y prendre
Je ne sais pas si je dois faire réagir les espèces avec de l’eau dans un premier temps
Ou plutôt essayer de faire réagir les espèces ensemble

Règle de base de la méthode de réaction prépondérante :
on regarde les espèces présentes et on fait réagir l'acide le plus fort sur la base la plus forte.
Cela donne quoi ?
Pour l'autre exercice idem : l'oxydant le plus fort sur le réducteur le plus fort.

Il me semble que les équations de dissociation sont:
NH2OH —> NH2+ + HO-
NH4Cl —> NH4+ + Cl-
NaOH —> Na+ + HO-

Quels sont les acides et les bases initialement présentes ; quel est l'acide le plus fort ? Quelle est la base la plus forte ?

Je pense que l’acide le plus fort appartient au couple NH3OH+/ NH2OH
Et la base la plus forte appartient au couple NH4+/NH3
(J’ai regardé avec les pka mais je ne suis pas sûre de moi)

Vous avez mis en solution NH2OH : c'est une base pas un acide.
Idem : vous avez mis en solution NH4+ c'est un acide pas une base.
On fait réagir les espèces présentes

NH4+ + NH2OH —> NH3 + NH3OH+
Je pense qu’il s’agit de la réaction entre les deux espèces présentes
D’ailleurs j’avais une question s’il vous plaît il faut toujours faire les réactions de différenciation et ensuite faire réagir les espèces présentes s’il vous plaît?
Et aussi pourquoi on n’utilise pas le NaOH s’il vous plaît

Dans vos espèces présentes, vous en avez oublié une : 0,02 mole de soude. (cela répond à votre "pourquoi on n’utilise pas le NaOH" : on l'utilise !)
Dernière modification par gts2 ; 31/12/2023 à 17h19.


Excusez moi je voulais dire équation de dissociation
Et comment faire pour faire réagir la soude s’il vous plaît (c’est vraiment ça qui me pose problème comment faire pour faire réagir trois espèces ensemble)

On effectue les réactions de dissociation qui sont totales, simplement parce qu'il n'y a pas, par exemple, de NaCl ou de NaOH dans l'eau, et donc commencer une étude en considérant comme espèces présentes NaCl ou NaOH, dont on est sûr qu'elles ne sont pas présentes, parait quand même difficile.
Il ne s'agit pas de faire régir trois espèces ensemble mais deux : l'acide le plus fort et la base la plus forte.
On en revient au début : quelles sont les espèces présentes (initialement après réaction de dissociation) ?

Je vous remercie pour les indications
Les espèces présentes initialement sont NH4+, NH2OH et pour NaOH je ne pense pas qu’il est présent car il s’agit d’une base forte qui se dissocie complètement dans l’eau


Na+ est un ion spectateur donc je pense qu’il y’a HO- présent

Bien on a donc
NH4+, NH2OH, H2O, Na+, HO-, Cl-
Il n'y plus qu'à trouver l'acide le plus fort et la base la plus forte.

L’acide le plus fort est NH4+ car il a un pKa de 9,2 et la base la plus forte est NH2OH
Mais je ne suis pas sûre de moi

Et HO- vous en pensez quoi ?

Si place HO- dans son couple H2O/HO-
Son pka sera de 14
Mais à vrai dire je ne sais pas

Vous avez un couple donc le pKa est grand donc l'acide est très faible et la base forte.
HO- est la base la plus forte qui puisse exister dans l'eau et réciproquement pour H+.
Vous n'avez vu ce genre de graphe ?
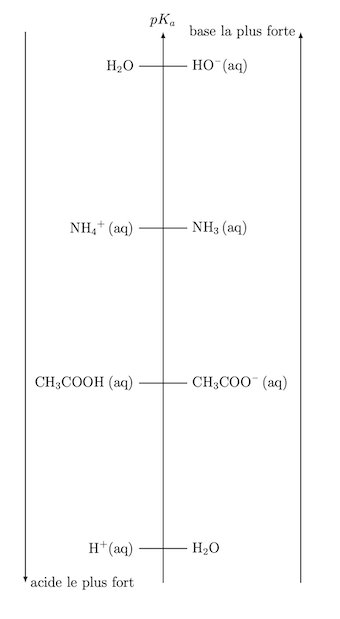

Si j’avais fais au brouillon ceci, mais je ne savais pas si c’était bon ou faux
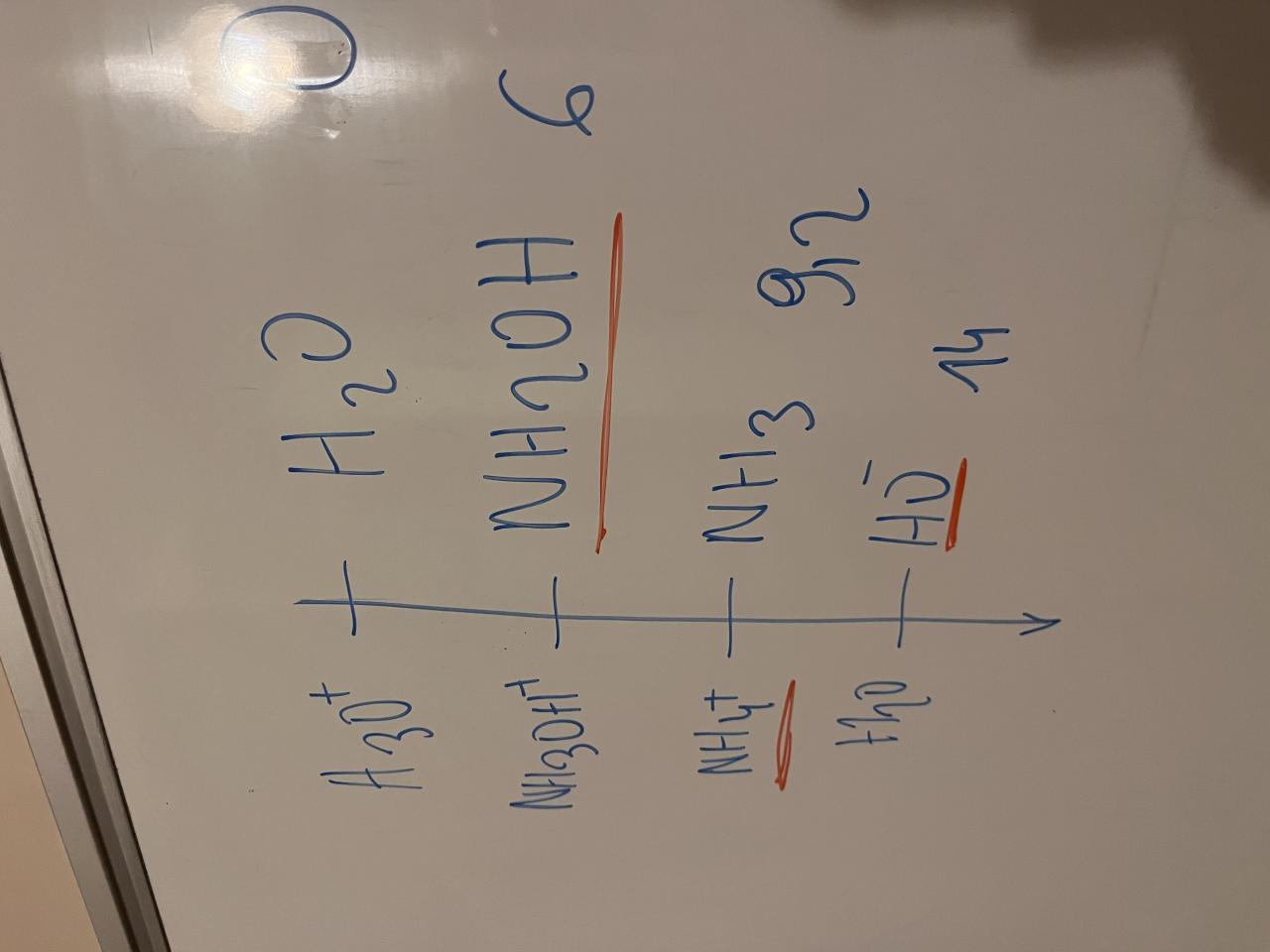

Peut-être : que signifie souligné en rouge ? SI ce sont les espèces présentes, il manque l'eau.
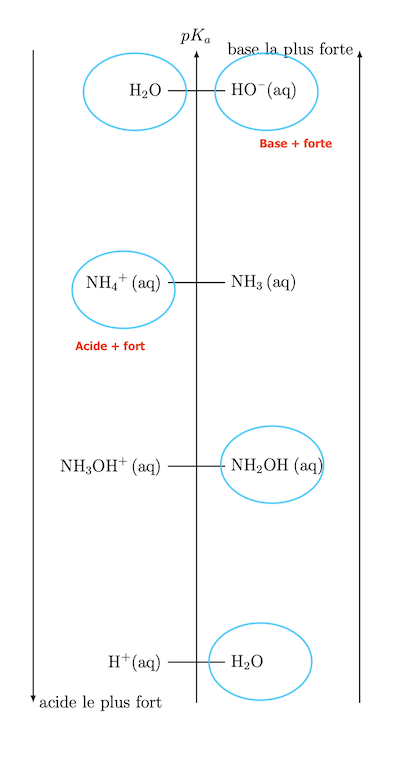

Oui excusez moi j’ai oublié l’eau
Est ce que je peux maintenant faire réagir NH4+ avec HO- ou ce n’est pas bon

Cette fois c'est bon.

Donc normalement ça me fait
NH4+ + HO- —> NH3 + H2O

Etape suivante : vous déterminez la composition de la nouvelle solution et vous recommencez.

Comment puis-je faire ça s'il vous plait
NH2OH va intervenir dedans?

Il y a une règle et une seule dans votre méthode : acide le plus fort sur base la plus forte ce qui dans votre cas donne ?

Normalement ça me donne ça
NH4+ + HO- —> NH3 + H2O
Mais je dois trouver la composition de la nouvelle solution

