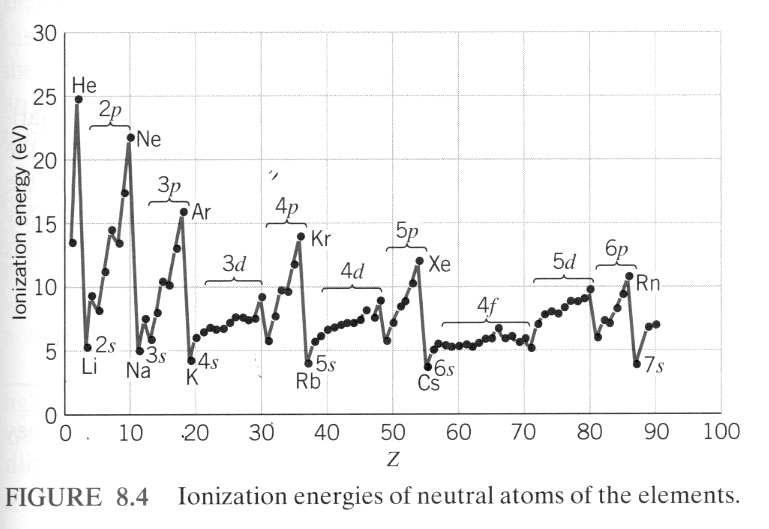
bonjour,
voila un petit problème sur lequelle je bute encore. Lorsque l'on regarde le tableau des ionisations. On se rends compte que les energies d'ionisations n'ont pas les mêmes valeurs bien que les electron appartiennent a la même couche.
Example :
1) pour l'helium on a 24.587 ;54.46 comme energie d'ionisation.
est il possible de dire que temps que l'atome d'heluim a ces 2 electrons. Que ces 2 electrons ont une energie de 24.587Ev tant qu'il y a 2 electron autour du noyau
2) pour le carbonne on a 11.26;24.383;47.887;64.492;392 .077;489.981
est il possible de dire que temps que l'atome de carbonne que ces 4 electron de la seconde ont tous une energie de 11.26Ev tant qu'il y a 4 electron dans sa couche.
-----