Bonjour à tous ,
J'ai un devoir maison à faire pour mardi 5 novembre mais je n'ai pas très bien compris voilà le DM:
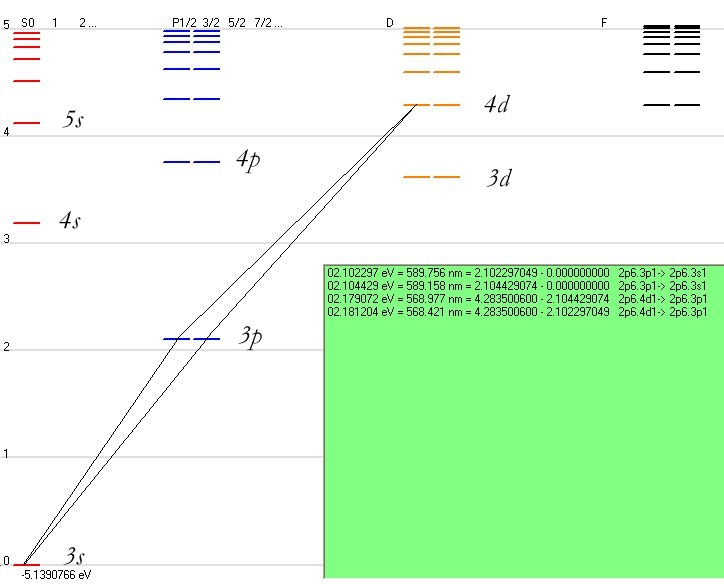
Les lampes à vapeur de sodium utilisées pour l'éclairage public émettent une lumière jaune-orangée. On donne les
niveaux d'énergie suivants du sodium : E0 = 0 eV, E1 = 2,105 eV, E2 = 2,107 eV, E3 = 4,293 eV
1. Représenter les niveaux du sodium sur un diagramme énergétique sans se soucier de l'échelle.
[I]Je crois avoir bon à cette question ,en placant chaque niveaux d'énergie avec comme état fondamental E0=0eV.
2. Déterminer en électronvolt, puis en joule, l'énergie des photons associés à toutes les transitions possibles entre les
états de ces niveaux d'énergie
Les transitions possibles: E3-E2,E3-E1,E3-E0
E2-E1,E2-E0
E1-E0
Ensuite pour convertir en joule on fait surement un produit en croix :1eV = 1.6x10(puissance -19) Joule
3. Une lampe à vapeur de sodium émet un doublet (c’est-à-dire deux raies de longueur d'onde très proches) orange et
un autre vert-jaune.
a. Exprimer la longueur d'onde dans le vide d'une radiation en fonction de l'énergie du photon, de la célérité c de la
lumière et de la constante de Planck h.
LAMBDA = hxc/(energie en joule )
b. Calculer les longueurs d'onde dans le vide des quatre radiations correspondant aux deux doublets.
Je ne sais quelle radiations , celle de la question 1 ?
-----