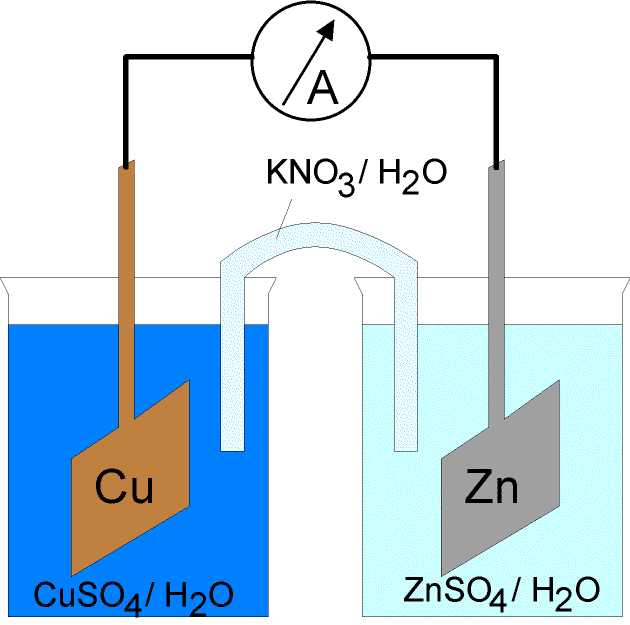
Bonjour,
J'ai 2mL d'ions en solution, disonsconcentré dans l'eau . J'en prends 1mL dans une pipette, est-ce qu'on sait (à température ambiante ?) la probabilité qu'il y ait au moins 48 anions
de plus dans le mL que j'ai pipetté que dans l'autre ?
Je pose cette question car j'ai l'impression qu'une probabilité non nulle est indispensable pour la mise en route d'une pile redox Zinc/Cuivre (pile de Daniell).
En effet, il faut que des cations/anions du pont salin aillent respectivement dans les solutions côté cuivre et côté zinc, et cela prend un temps non nul (contrairement au temps que met un électron à "parcourir" le fil électrique qui est non nul mais extrêmement rapide) pendant lequel il y a un déséquilibre de charge macroscopique en tout cas au moment de la mise en route de la pile redox.
Ça impliquerait d'ailleurs que la distance pont salin / électrodes détermine le temps de mise en route de la pile, qui pourrait mettre très longtemps à démarrer si l'écartement est un peu grand.
Merci !
-----