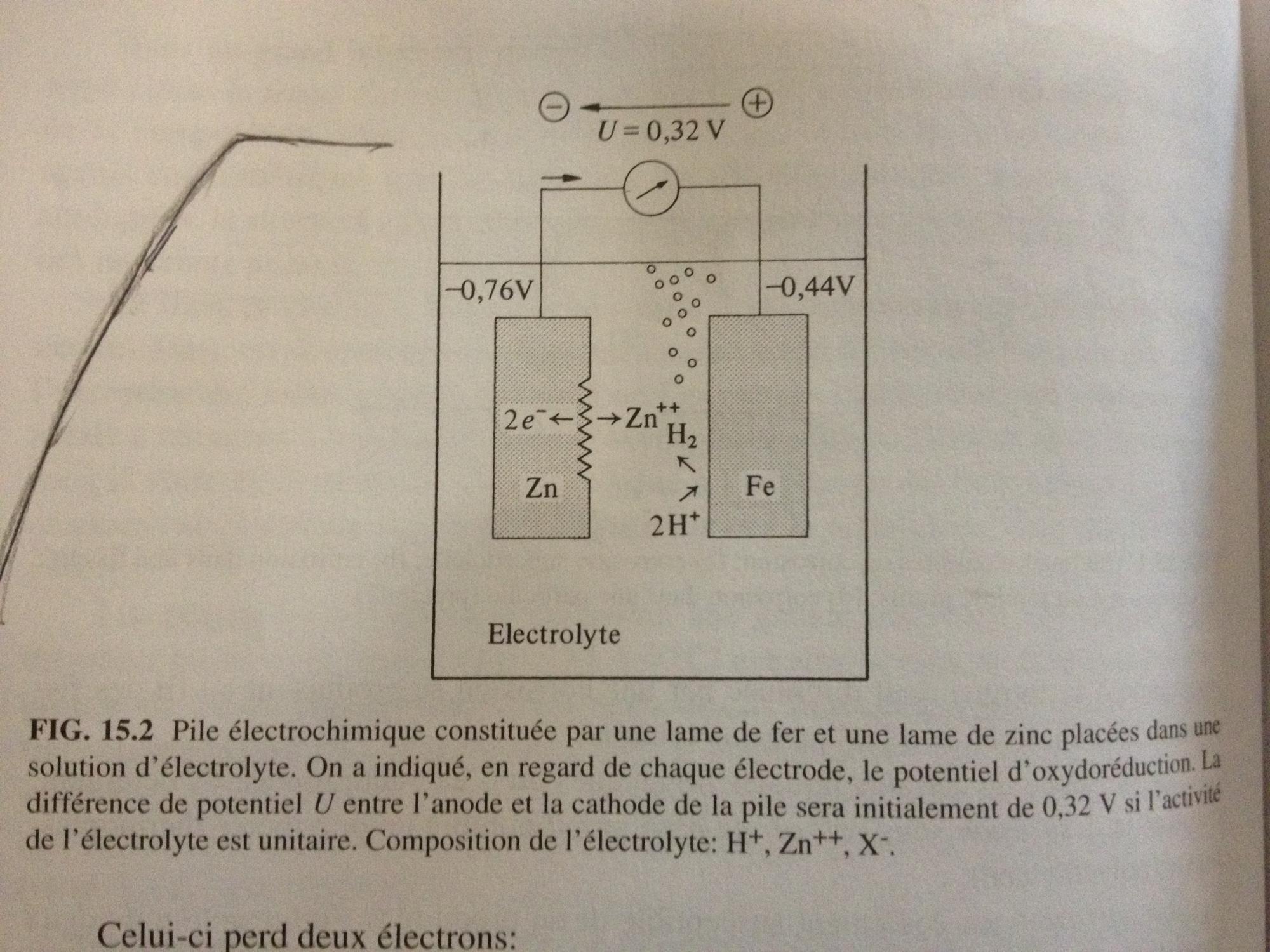
Bonsoir,
j'ai besoin de vos lumières svp car j'y comprends pas grand chose à ces trucs. Ce que je croyais c'était que l'anode gagne des électrons (elle est donc chargée -) et la cathode perd ses electrons (elle est +).
Mais je viens de lire un livre qui dit que pour protéger un matériau on fait une galvanisation (déposer une couche de Zinc) et :
"en cas de rupture de la couche de zinc, celle-ci fonctionne comme une anode et la protection continue à être efficace".
Mais selon ce que je comprends :
- si le Zinc fonctionne comme une anode alors il gagne des électrons
- c'est donc l'acier à protéger qui en perd et c'est donc lui qui s'oxyde et donc s'habime ?
Il y a quelque chose qui dont être faux dans mon raisonnement sinon ça voudrait dire que la galvanisation n'est pas efficace... mais je ne trouve pas mon erreur.
j'espère que vous pourrez m'aider à mettre tout ça en place
-----