Bonjour,
Voici l'exercice suivant sur lequel je ne comprends pas vraiment le raisonnement :
" Un récipient de volume initial Vi = 3.0l contient m = 1.0 g, d’eau à la température T0 = 100°C. On donne pour l’eau
• la pression de vapeur saturante à 100°C : Pv (100°C) = 1.0bar.
• L’enthalpie massique de vaporisation : lv = 2.26 kJ kg−1.
• la vapeur d’eau sèche est considéré comme un gaz parfait.
Par déplacement lent, quasi-statique du piston, on réalise sur ce système une compression isotherme jusqu’au volume final Vf = 1.0l.
Préciser la composition du système dans les états initial et final. "
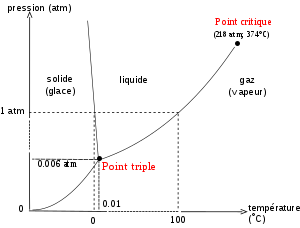
Pour visualiser cette transformation, j'ai tracé le diagramme P,T de l'eau. J'en joins un ci-dessous:
Ensuite, je me suis dit que 1.0g d'eau liquide ne pouvais pas occuper un volume de 3.0L, donc l'état initial n'est pas composé uniquement d'eau liquide.
*Si l'eau est que sous forme de vapeur, la pression du gaz vaudrait P=0.57bar
*Si l'eau est présente sous deux formes, alors la pression du système doit être égale à la pression de vapeur saturante.
C'est à ce moment là que je bloque, je ne sais pas comment faire pour savoir lequel de ces deux raisonnements est plus logique que l'autre.
Dans la correction, il est écrit que si l'eau est sous la forme liquide et gazeuse, alors la pression sera inférieure à 0.57bar (pression du système composé uniquement de vapeur d'eau), et donc inférieure à la pression de vapeur saturante.
Je ne comprends pas pourquoi la pression de l'eau liquide et gazeuse serait inférieure à la pression de l'eau gazeuse, parce que sur le diagramme P,T , on voit que la pression de l'eau gazeuse est inférieure à la pression de l'eau liquide et gazeuse à température égale.
Merci d'avance pour votre aide.
-----