Bonjour,
Voila j'essaye actuellement d’amplifier un plasmide par PCR pour réaliser un clonage par recombinaison homologue.
Mon problème ce situ au niveau de ma PCR visant à amplifier mon plasmide. J'obtiens après chaque run et sur un gradient d'hybridation allant de 58 à 67°C des bandes non spécifiques (4 ou 5) a des tailles comprises entre 1.5kb et 1kb alors que la taille de mon fragment attendu est de 6.5kb environ.
Précision ma Tm est aux alentours de 55°C le fabricant recommande 3°C au dessus.
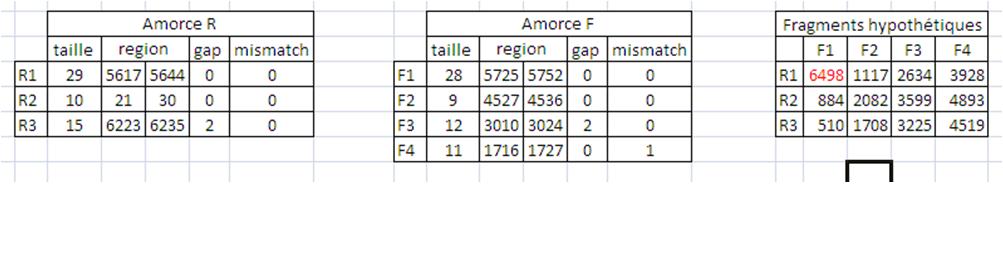
J'ai réalisé un alignement entre la séquence du plasmide et les amorces (PromoterWise) il n'y a rien qui expliquerai des hybridations non spécifiques et encore moins c'est taille la d'amplicons
Petit tableau récapitulatif :
Cliquez pour afficher
Voila ou j'en suis je précise que j'ai linéarisé mon plasmide sur gel et purifié la bande pour tenter de résoudre le problème sans résultat. J'ai aussi essayé une première fois avec des "amorces simples" (sans bras d'homologie 29pb) j'ai eu ces bandes non spécifiques mais également mon plasmide amplifié alors que l’emploi de "Méga amorces" (amorces simples + 50pb homologues a la séquence a insérer) n'a donné que de l'amplification non spécifique ....
J’attends vos idées ou vos questions si je n'ai pas était assez clair !!
Merci de votre attention
Alban
-----