bonjour,
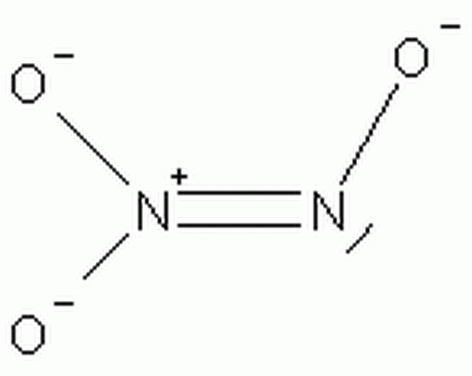
Il y a quelque temps je suis tombée sur le sel d'angeli et sa structure.
Je ne comprend pas comment il est possible que l'un des deux azote soit pentavalent.
j'ai essayé de comparer avec la structure de N203
J'ai penser à délocaliser la double liaison de l'oxygene se trouvant tout a droite, cependant, à ce moment là, l'oxygene porterait une charge +.
Je pense aussi que le doublet non liant du second azote entre en jeu, mais je ne vois pas comment.
si quelqu'un a une idée...
Merci d'avance.
-----