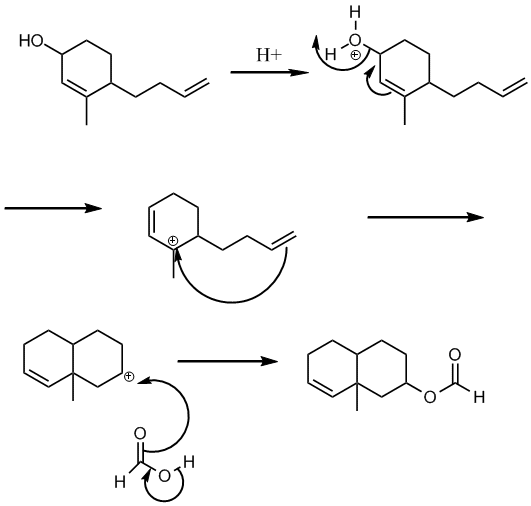
Bonsoir
Voila mon probleme, je ne parviens pas à determiner un mécanisme réactionnel expliquant la réaction suivante:
http://chemistry-physics.ifrance.com...e_reaction.jpg
La seule étape etant celle indiquée sur l'image avec ses conditions associées.
Certes je vois qu'il y aura une réaction d'estérification, mais c'est la modification de la structure carbonée qui me pose le plus de problème.
Soit il y a une réaction que j'ignore ou à laquelle je n'ai pas pensé soit il est possible qu'il y ait une erreur dans l'énoncé mais je doute...
-----