Bonsoir à tous,
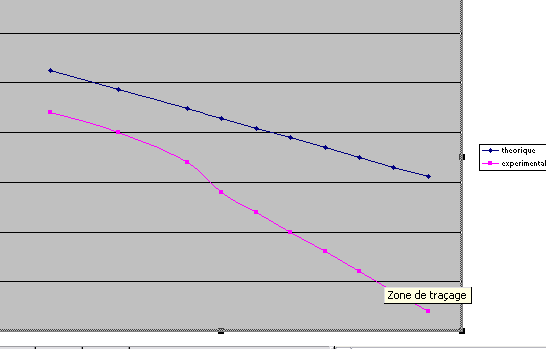
Voici une courbe représente logX =f(1/T) avec X fraction du composé a T de solubilité(solide se dissolve)
En bleu (droite) logX =f(1/T) c’est la courbe théorique pour une solution idéal.
En violet c’est la courbe expérimentale.
Le système étudié est le binaire Hexane-Heptane. Comme ces composés ont une constitution chimique voisine,on devrait avoir une solubilité qui converge vers l’idéal.
Vous remarquerez que les deux courbes sont parallèles dans un premier temps, puis à une certaine température l’on constate la divergence de la courbe expérimentale.
Comme expliqué déjà le premier écart entre la courbe expérimental et théorique.
Et a quoi est du la divergence subite de la courbe expérimental (à une certaine température).
Merci.
Ps :si vous avez des documents concernant la solubilité idéal,ils seraient bienvenu.
-----





 , ou µ° est le potentiel chimique de l'état de référence, donc du constituant pur.
, ou µ° est le potentiel chimique de l'état de référence, donc du constituant pur.


 (ça reste intéressant, mais ça ne résout pas le problème)
(ça reste intéressant, mais ça ne résout pas le problème)