Voila la petite partie d'un DM que j'ai a faire en spé chimie ... et les questions que j'ai mise , je ne connais pas la reponse alors si vous voulez bien m'aider un peu ce serrai super sympa !!
menthol:C9H18CHOH ; menthone: C9H18CO
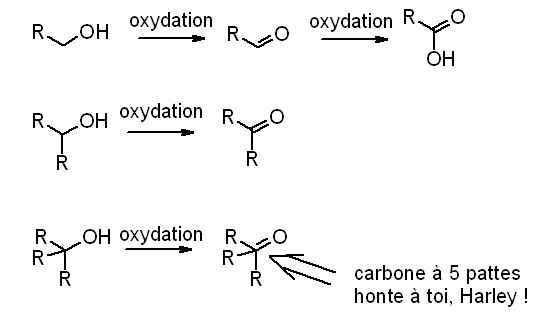
1- a quelle classe d'alcool peut on ratacher le menthol (je pense que c'est un secondaire) ?
2- l'oxydation du menthol est réalisée par l'ion permenganate . Cette oxydation se traduit par l'équaton bilan :
2MnO4- + 5C9H18CHOH + 6H3O+ = 2Mn2+ + 5C9H18CO + 14H2O
On traite une masse m1=15,6 g de menthol; on utilise un volume V=100mL de solution oxydante de concentration C=0,80 mol/L acidifié par quelques mililitres d'acide sulfurique concentré. On utilise un chauffage a reflux.
a-pourquoi un chauffage a reflux ?
b-y a-t-il un réactif en excés ?quelle masse théorique m2 de menthone peut on obtenir ?
Il reste d'autre question mais je les ai déja faite , c'est simplement cette partie (moi et les tableaux d'avancement ...) .
Merci d'avance a tout ceux qui me répondront !
Joffrey !
-----





 ) !
) !
