Bonjour,
Je me suis déjà présenté étant bachelier. Maintenant, je suis étudiant en 1ère année de médecine, et pour ne rien vous cacher, la chimie me pose d'énormes problèmes.
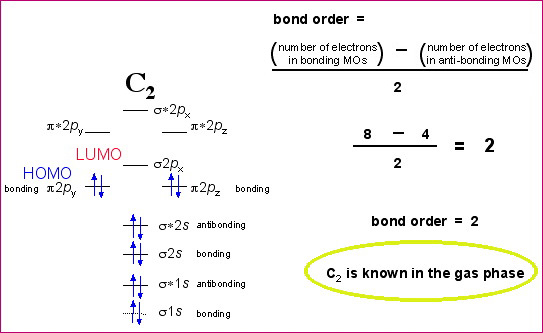
Cela fait plus de deux heures que je navigue sur le web sans trouver de réponse à mes questions: J'ai cherché en vain des exemples de diagrammes pour molécules avec et sans interactions sp. Le seul site intéressat que j'ai trouvé est celui-ci: http://www.meta-synthesis.com/webboo...diatomics.html mais ils ne parlent pas d'interaction sp. Ce serait très aimable si quelqu'un pouvait me fournir un exemple de ce genre. Ensuite il y a 2 autres questions que me posent problème, qu'est-ce qu'on entend par diradical, paramagnétique diamagnétique et ordre de liaison.
Merci et désolé si je vous irrite avec des questions qui doivent vous sembler banales.
-----







 liante et
liante et