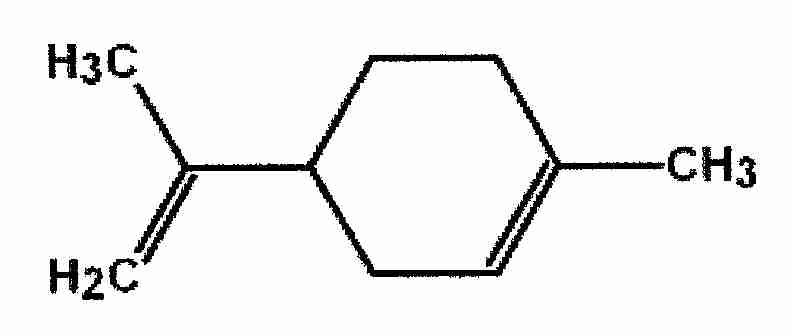
Soit le limonène
Si l'on fait l'addition de deux molécules de HCl sur cette molecule, obtient-on des isomères?
J'ai cherche mais j'en ai pas trouve mais semblerait-il il y en a .
Sur la molécule de départ il y a un carbone asymétrique.
Mais l'addition de HCl sur les deux doubles liaisons élimine cette configuration .(suivant la regle de markovnikov)
Doit-on considérer les produits minoritaires obtenus ?
Merci pour vos réponses.
-----