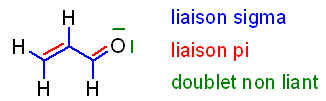Bonsoir à tous!
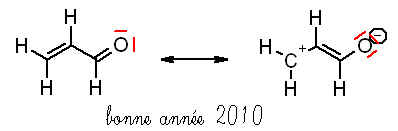
Étude de la molécule d’acroléine CH2CHCHO.
1) écrire pour cette molécule une structure de Lewis en faisant pas apparaître de charges.
H H H
| | |
c=c--c=o\\ (\\ double liaison non liante sur l’oxygène )
|
H
2)déterminer la géométrie de l’atome d’oxygène et des atome de carbone à l’aide de VSEPR
Pour O: AX2E2 ; géométrie coudée ou AXE2 mais du coup je sais pas ça correspond a quel géométrie?
J’hésite entre les 2.
Pour le 1er carbone (C1): AX3; triangulaire
C2: AX3
C3:AX3
3)En déduire l’hybridation des atomes de carbone et d’oxygène.
Pour oxygène : hybridation sp3
Pour les carbones c’est une hybridation de type sp2.
4)Représenter le squelette sigma de cette molécule en indiquant le nombre de paire électronique liantes et non liantes associée a ce squelette.
J’ai du mal à vous le dessiner ici mais je trouve 2 paire liante et 3 paire non liantes. Avez-vous la même chose?
5) Y a-t-il un système pi dans cette molécule? Si oui, Entre quel atomes et à l’aide de quel orbitale ce système est constitué? Combien d’electron contient-il? Représenter le système pi de cette structure.
OUI,entre les 2 doublet non liant de l’atome d’oxygène; il contient 4 électrons.
6) écrire pour cette molécule une autre structure de Lewis faisant apparaître des charges.
Ici je sais pas du tout comment faire?
7)déterminer la géométrie de l’atome d’oxygène et des atome de carbone à l’aide de VSEPR pour cette nouvelle structure. En déduire l’hybridation des atomes de carbone et d’oxygène.
8)Représenter le système pi de cette nouvelle structure
9)La longueur de la liaison c--o dans la molécule CH2CHCHO est de 123pm. Interpreter cette valeur sachant que la longueur d’une simple liaison c--o est de 143pm et que la longueur d’une double liaison c==o est de 120pm.
Merci pour toute l’aide apportés, c’est important pour moi de comprendre cette exercice.
-----