Bonjour,
Je viens tout juste d'entamer (avant les vacances) le chapitre sur la réactivité de la double liaison C=C. C'est pourquoi j'aimerais comprendre un exercice et sa correction (donnés par le prof), parce que j'ai vraiment du mal à comprendre certaines notions... qui n'ont par ailleurs, pas été vues en cours.
Voici l'exercice en question:
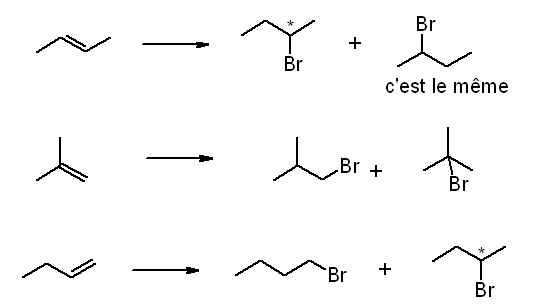
Etourdi, un étudiant a abandonné à l'air sur sa paillasse un alcène de formule brute C4H8. Ayant par la suite oublié la formule développée de cet alcène, il tente de la déterminer en le faisant réagir avec HBr en présence de lumière. Il obtient trois isomères tels que: %A >> %B=%C.
Trouver de quel alcène il s'agit en précisant le mécanisme. Discuter de la stéréochimie des produits obtenus.
Dans la correction de cet exercice, il est dit que l'addition du HBr sur l'alcène est radicalaire (c'est dû en effet à la présence de lumière, ainsi que le caractère radicale de l'atome de brome, je crois?).
Il est dit ensuite, qu'elle est régiosélective (mais que cette régiosélectivité est régie par l'effet Kharasch) mais non-stéréosélective car le carboradical, l'IR donc, est statiquement plan. D'où ça sort? :O? Comment savoir qu'une réaction n'est pas stéréosélective?
Ensuite, il existe 4 isomères de formule brute C4H8. J'ai commencé par essayé de comprendre l'addition du HBr sur le but-1-ène (qui est d'ailleurs l'alcène cherché!).
Ca commence par un amorçage, donc HBr -> H- + Br -.
La propagation:
ce que je ne comprends pas, c'est pourquoi celui de gauche est majoritaire (la raison (correction): carboradical plus stable car classe secondaire).
Quel carbone faut-il regarder? Celui qui est lié à Br?
De même, si c'est régi par l'effet Kharasch, le Br doit se lier à l'atome le moins substitué donc le plus hydrogéné, ce qui est le cas du gauche...si j'ai bien compris?
Ce que je ne comprends pas aussi, c'est les phases du mécanisme:
pourquoi après l'étape de la propagation, on fait réagir le produit avec HBr (?)
Merci de bien vouloir m'éclaircir tout ça....
Bonnes fêtes!
-----