Bonjour.
Bonne année 2010 tout d'abord.
J'ai un DM en chimie pour la rentrée (ce lundi) mais l'ennui c'est que je n'ai (presque) rien compris à la leçon, j'aimerais donc de l'aide pour le faire.
Voici le DM en question :
Cliquez pour afficher
I) Représentation de Lewis de quelques molécules :
1) Les molécules étudiées contiennent les atomes indiqués dans le tableau ci dessous qu'on complétera
Element H C N O CL
Num.atomique Z=1 Z=6 Z=7 Z=8 Z=17
Configuration électronique
Nb d'électrons couche externe
Nb d'électrons ‘manquants' pour vérifier la règle du duet ou de l'octet
2) Soient les formules des molécules suivantes H2 . Cl2 H2O ; NH3 (ammoniac) ; CH4 (méthane) ; C2H6 (éthane) ; N2 ; C2H4 (éthylène) et CO2.
Pour toutes ces molécules vous indiquerez dans un même et unique tableau
-Le nom et la formule brute de ces molécules
-Le nbre total d'électrons externe ne
- Le nbre de doublets dans la molécule nd
- La formule de Lewis de cette molécule
- La nature des doublets (liants ou non liants)
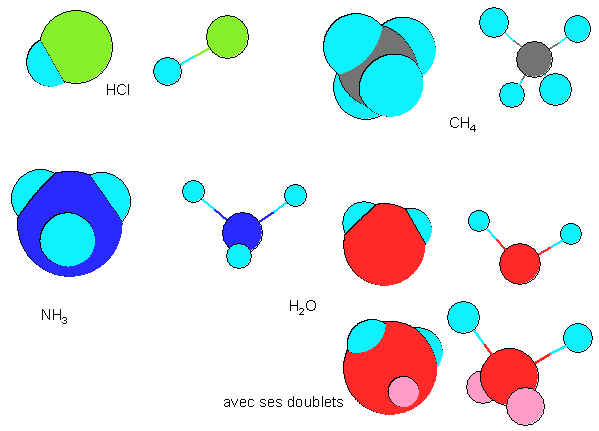
II) Etude de la géométrie de quelques molécules simples
Il est possible de construire 2 types de modèles moléculaires :
Les modèles éclatés : ils permettent de bien visualiser les angles de liaison
L'échelle de représentation des longueurs de liaison n'est pas respectée
Les modèles compacts : ils traduisent un peu mieux la réalité, les atomes étant en contact les uns avec les autres
1) Construire en modèle compact et en modèle éclaté les quatre molécules
HCl ; CH4 ; NH3 et H2O
2) Indiquez la géométrie de chacune de ces molécules (linéaire, tétraédrique, pyramidale ou coudée)
3) On constate que les molécules CH4 et NH3 ne sont pas planes et que H2O est coudée. Sachant que les doublets d'électrons (liants et non liants) occupent un certain volume, est-il possible d'expliquer ma forme de chaque molécule ?
III) Notion d'isomérie
1) Le méthane est la plus petite molécule d'hydrocarbure faisant partie de la série des alcanes. Le suivant est l'éthane de formule brute C2H6 et dont la formule de Lewis a déjà été vu. Construire cette molécule en modèle éclaté.
2) Partant de cette molécule, construire la molécule suivante de la série des alcanes : le propane de formule brute C3H8.
Ecrire sa formule de Lewis qui se confond ici avec sa formule développée. (Dans une formule dev., on représente toutes les liaisons par des tirets) Cette formule nous informe-t-elle sur la forme réelle de la molécule ?
3) Sur le même principe, construire la 4e molécule de la série : le butane C4H10. Ecrire sa formule développée puis sa formule semi développée : c-à-d une formule dans laquelle seules les liaisons carbone - carbone sont représentées (on ne représente pas les liaisons des atomes d'hydrogène)
4) Partant de cette dernière molécule, le « jeu » consiste à construire une nouvelle molécule avec les même atomes : 4 atomes de carbone et 10 atomes d'hydrogène. Ecrire sa formule développée puis sa formule semi développée. Il s'agit du 2-méthylpropane qui constitue un isomère du butane.
Donner une définition de l'isomérie
Merci à vous.
-----