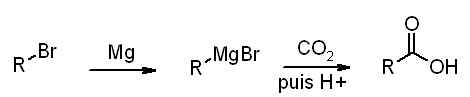Bonjours à tous,
J'ai un exercice pour mardi de chimie organique mais je bloque quelque peut. Merci de m'aider si possible.
On réalise l'hydrolyse en présence de soude concentré d'un ester noté E. Après acidification on obtient deux composés A et B
Étude de A
On dispose des renseignements suivants :
A est constitué de carbone, hydrogène et oxygène
L'analyse de A montre qu'il contient 68,9% de Carbonne et 4,9% d'Hydrogène
Une masse de 0.1464 g de A est neutralisée par 12,00ml de soude de concentration molaire 0,1000 mol.l-1
A est un composé aromatique (dérivé du benzène)
Masse molaire (g.mol-1) C : 12 H : 1 O : 16
2.1.1 Ecrire l'équation générale de la réaction de neutralisation de A par la soude
J'ai mis R-COOH + (Na+ +OH-)---> (R-COO-+Na+) + H2O
2.1.2 Déterminer la masse molaire de A
J'ai fait MA=mA/C.Ve MA= 0,1464/(0,1*12.10-3) = 122g.mol-1
2.1.3 déterminer la formule brute de A
J'ai fait 12n+2n+32=122 14n=90 n=90/14=6,4=6
C6H12O2
2.1.4 Donner la formule semi-développée et le nom de A
J'avais écrit un acide hexanoïque mais comme c'est un dérivé du benzène ca ferrait de l'acide benzoïque mais cela ne respecterais plus ma formule brute de A donc je suis coincé.
2.1.5 Proposer une synthèse de A à partir d'un organomagnésien
Je ne sais pas comment faire comme ca j'ai pas la réponse précédente et de plus je l'ai jamais fait en cour :S
Voila merci de m'aider pour les deux dernière questions si possible s'il vous plaît et de m'aider a corriger mes erreurs.
-----