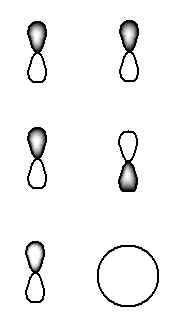Bonjour,
j'ai un examen dans 2 semaines et je suis dans une sacré misere.
Je comprend pas grand choses dans les orbitales moleculaires concernant:
1) comment calculer l'indice de liaison.
dans ce cas je n'arrive pas à comprendre comment le faire. n=nb de e- dans lorbitale liante et n* nb de e- dans l'O antiliante.
Dans le cas de H2 pourquoi n*=0?? galere!!!
dans He2 pourquoi n*=2 galere...
2) quand est ce que on a une symetrie sigma et quand est ce que on a pi?? comment les faire??
3) comment tracer le diagramme?? avec les sigma* et pi?? aucune idée de resoudre ces problemes...
Grand merci pour ce qui voudra m'aider...
-----