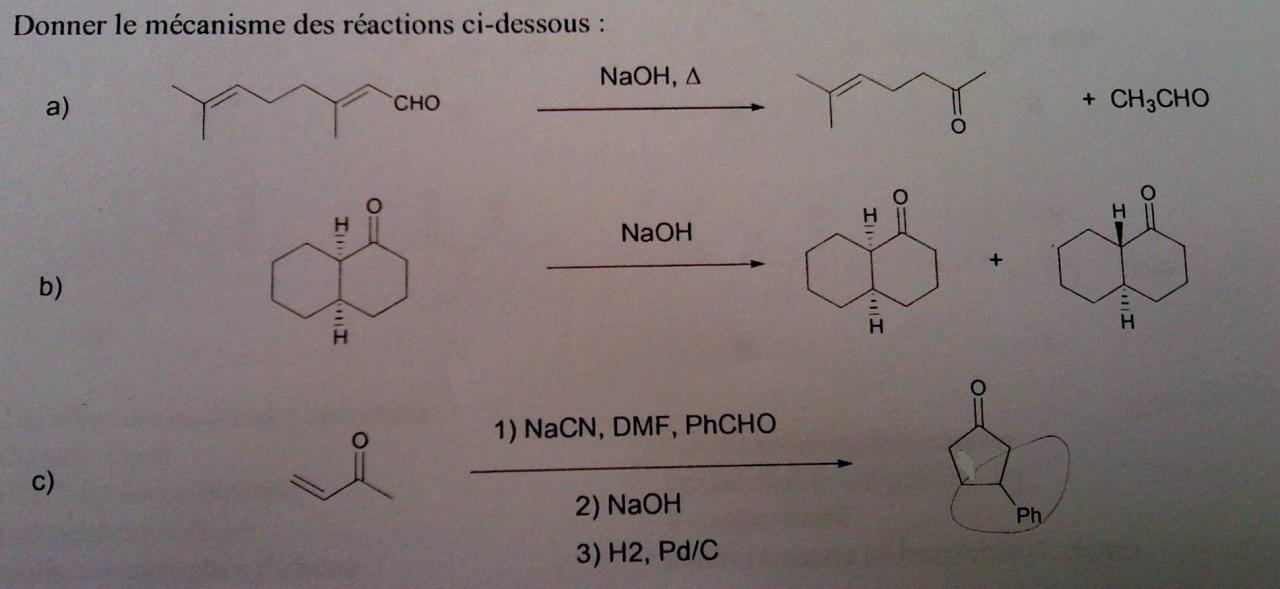
Bonjour à tous!
Je sollicite un petit coup de main sur une des étapes de cette synthèse et notamment le rôle de l'APTS (pièce jointe) et je fournis également l'étape déjà effectuée, ainsi si vous notez des erreurs, vos remarques sont les bienvenues!
Merci d'avance!
PIC120301001.jpg
PIC120301002.jpg
-----