Bonjour,
Je suis entrain de réaliser un ballon-sonde dans le but de filmer ma région à haute altitude. J’envisage de gonfler mon ballon avec de l’hydrogène fait maison, pour des raisons pratiques (plus d’He chez les dépositaires Air Liquide, + de liberté dans la date du lancer).
Je me pose des questions concernant les risques inhérents à ce gonflage. Bien sûr, je compte réaliser la synthèse de l’hydrogène à l’extérieur, à l’écart de toute source d’ignition, mais vues les quantités de matière impliquées, je voulais exposer mon problème.
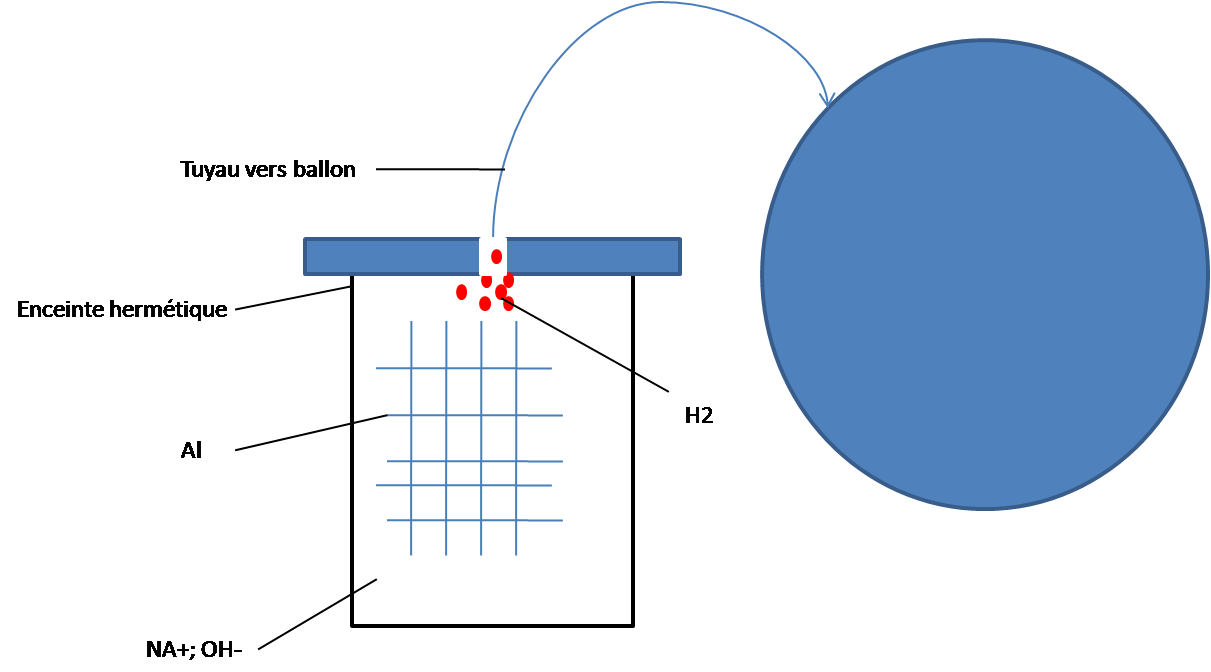
Je souhaiterais utiliser l’attaque de l’aluminium par la soude, selon le schéma suivant :
J’ai besoin d’un volume de 2m cubes de H2, ce qui implique l’emploi de 2,4 kg de soude, que je diluerai dans 10L d’eau, et de 1,6 kg de Al, ce qui impliquera un dégagement colossal de chaleur. Ma crainte : arriver jusqu’à la température d’auto-inflammation de l’hydrogène. J’ai essayé de quantifier le dégagement de chaleur pour estimer l’augmentation de température dans l’enceinte, mais mes souvenirs de thermo étant un peu loin, j’aimerais vous soumettre mon raisonnement.
La réaction en jeu est la suivante :
2Al + 6H2O + 2NaOH = 2NaAl(OH)4 + 3H2
J’ai calculé la variation d’enthalpie libre comme suit: ∆rG° = ∆rH° – T.∆rS°
Comme c’est la variation de température que je cherche à connaitre, j’ai utilisé Kirchhoff pour calculer ∆rH°, en me plaçant à 298 K et en disant dT = 0. J’ai alors :
∆rH° = ∆rH°(298K) = somme des enthalpies std à 298 K de mes constituants pondérés de leur coefficient stœchiométrique
J’ai trouvé les ∆rH°(298K), mais pas les ∆rS° alors j’ai laissé tomber l’entropie, et ∆rG° est environ égale à ∆rH°. (Là je pense que c’est horrible…). J’arrive à une variation d’enthalpie libre de -5168 kJ. La réaction est bien exothermique comme on s’y attendait, mais je trouve le chiffre un peu gros…
Ensuite, je veux savoir quelle augmentation de température cela dégage-t-il. Je me dit que ∆rG° = Q vu que la pression ne change pas trop dans le système. La température est reliée à la quantité de chaleur par :
∆rG° = Q = m.C.∆T, où m est la masse du composant et C sa capacité calorifique massique
Je suppose, en étant optimiste, que toute la chaleur se diffuse dans la solution acqueuse, donc dans l’eau, dont le C est 4185 J/Kg/K. Ce qui amène une élévation de température de 123°. Mais je ne suis absolument pas sûr de traiter correctement ce dernier point. Si j’avais considéré que la moitié de Q passait dans l’alu (C = 897 J/Kg/K ; avec une masse de 1,6 kg), alors je me retrouvais avec une élévation de température de l’alu de 1800K !! Là, tout explose…
Quelqu’un qui aurait eu la persévérance de me lire jusqu’au bout saurait-il m’aider, et corriger les points qui sont erronés ? Je pense que dire « ∆rG° = Q » est faux, mais je n’arrivais pas a relier ∆rG° et ∆T sinon. Par ailleurs, je ne suis pas sûr d’avoir pris le pb dans le bon sens…bref, votre aide est la bienvenue.
Merci beaucoup.
-----