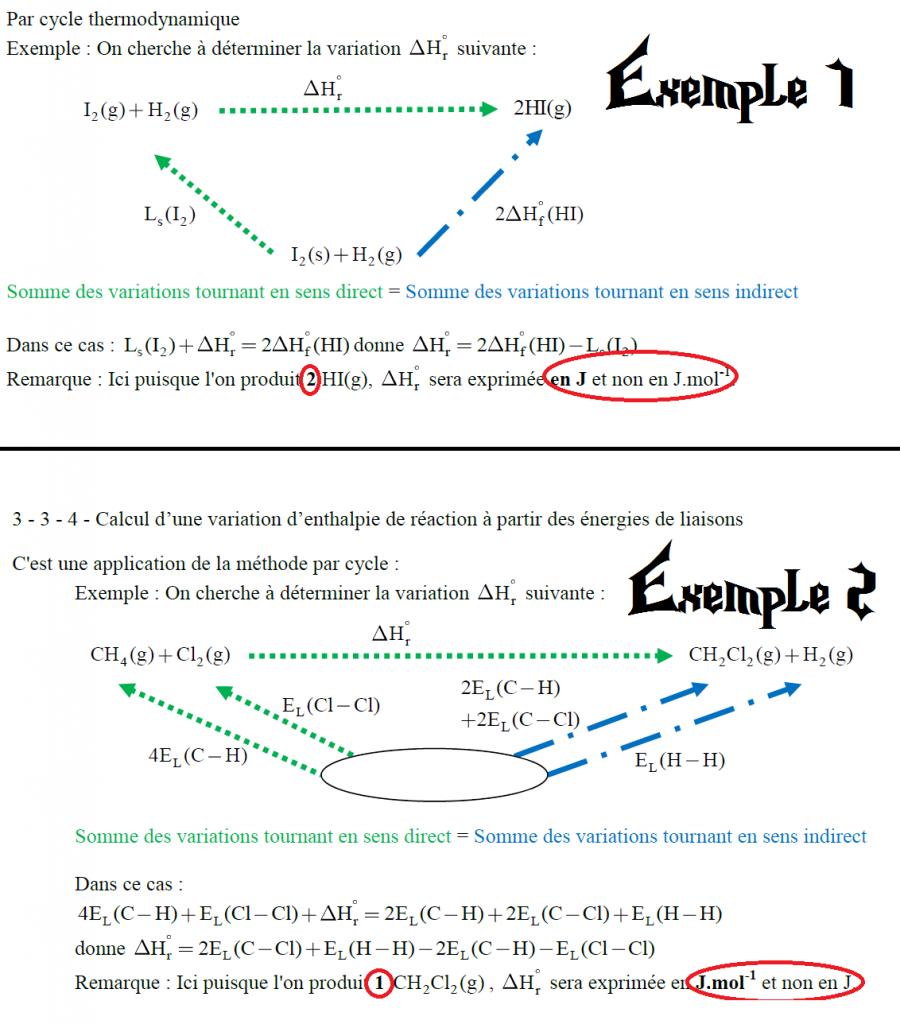
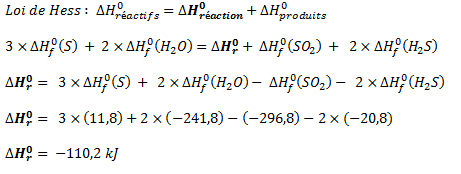Bonjour,
tout est dans le titre. je passe le concours de médecine dans une semaine, et je n'ai toujours pas capté quand mettre le résultat d'un calcul en Joule ou en Joule/mole.
J'ai deux exemples dans mon cours, qui "explique" ça, mais je ne comprends pas pourquoi...
voilà des screenshots de chacun des exemples de mon cours :
merci d'avance à la communauté ! j'en ai besoin avant mercredi prochain...
-----