Bonsoir,
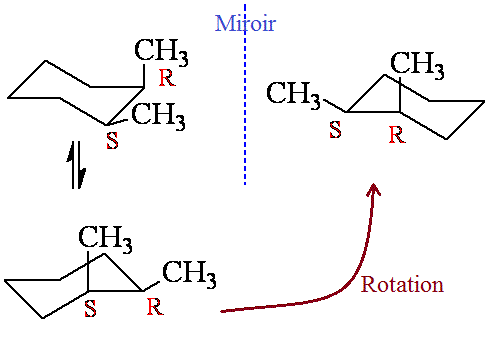
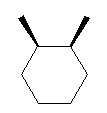
le cis-1,2-diméthylcyclohexane représenté en Cram laisse penser qu'il existe un plan de symétrie passant entre les carbones 1 et 2, ce qui le rendrait achiral.
Cependant, en représentation réelle, comme le cycle n'est pas plan en conformation chaise, il n'y a pas de plan de symétrie.
Alors pourquoi le cis-1,2-diméthylcyclohexane est achiral ? Le 1,2-diméthylbenzène est achiral et on le voit bien car le cycle est plan mais pour le cis-1,2-diméthylcyclohexane je ne comprends pas.
Merci.
-----