Bonjour tout le monde, j'aurais une petite question qui me tracasse depuis quelques jours. On m'a posé cette question dans un exercice et j'avoue que je ne comprends pas vraiment, la voici :
"Dans les réactions écrites ci-dessus, deux électrons sont libérés à l'anode alors que quatre électrons sont captés à la cathode. Que répondriez-vous à quelqu'un qui vous demanderait d'où viennent les deux électrons en trop ?"
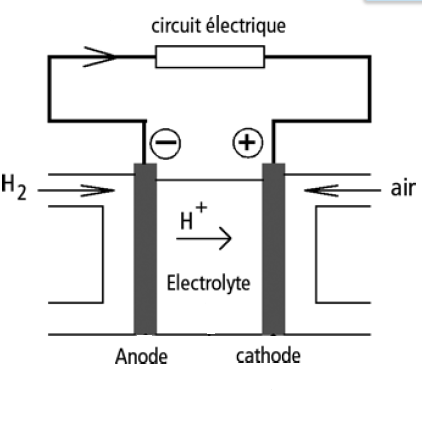
Sachant qu'on a plus haut :
Réaction à l'anode : H2 --> 2H+ + 2e-
Réaction à la cathode : O2 + 4H+ + 4e- --> 2H2O
Si vous voulez la photo jointe avec l'exercice :
-----





