Bonjour,
J’ai un exercice à faire en chimie et je bloque sur deux questions :
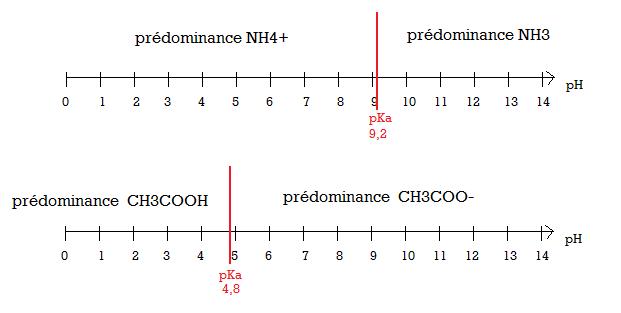
Données : pKa des couples acide/base
NH4+/NH3 pKa = 9.2
CH3COOH/CH3COO- pKa = 4.8
1. Sur un axe gradué en pH, placer les domaines de prédominance des formes de ces deux couples.
2. Les espèces NH3 et CH3COOH peuvent-elles êtres les espèces majoritaires de la même solution ?
3. En déduire la réaction qui se produit lorsqu’on mélange les deux espèces précédentes.
4. Exprimer la constante d’équilibre associée à cette équation et calculer sa valeur.
1. sa j’ai réussi à le faire (voir pièce jointe)
2. Je ne comprends pas ce qu’on me demande !! je n’est jamais entendu parler d’espèces majoritaires et je ne sais donc pas comment le savoir..
3. sa j’ai réussi à le faire :
NH3 + H+ = NH4+
CH3COOH = CH3COO- + H+
---------------------------------------------------------
NH3 + CH3COOH = NH4+ + CH3COO-
4. la je ne comprends pas, pour moi la constante d’équilibre c’est :
Ke = [H3O+]*[HO-]
Et à 25°C c’est égale à 10^-14
Du coup je voie pas ce qu’il veux que je fasse !
Si vous pouviez m’aider sa serrais super !
Merci
-----