Bonjour à tous,
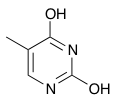
J'aurais voulu savoir si la thymine (cf. image jointe) était aromatique ?
J'ai trouvé sur internet que la structure était bien aromatique, mais je me demande bien les formes de résonance qu'elle peut présenter...
Cela impliquerait donc que les doublets non liants des azotes puissent se délocaliser, mais il me semblait que puisqu'ils étaient dans une OA de type p perpendiculaire au plan du cycle, alors il n'y avait pas de délocalisation possible.
Qui pourrait m'aider ?
MERCI !!
-----




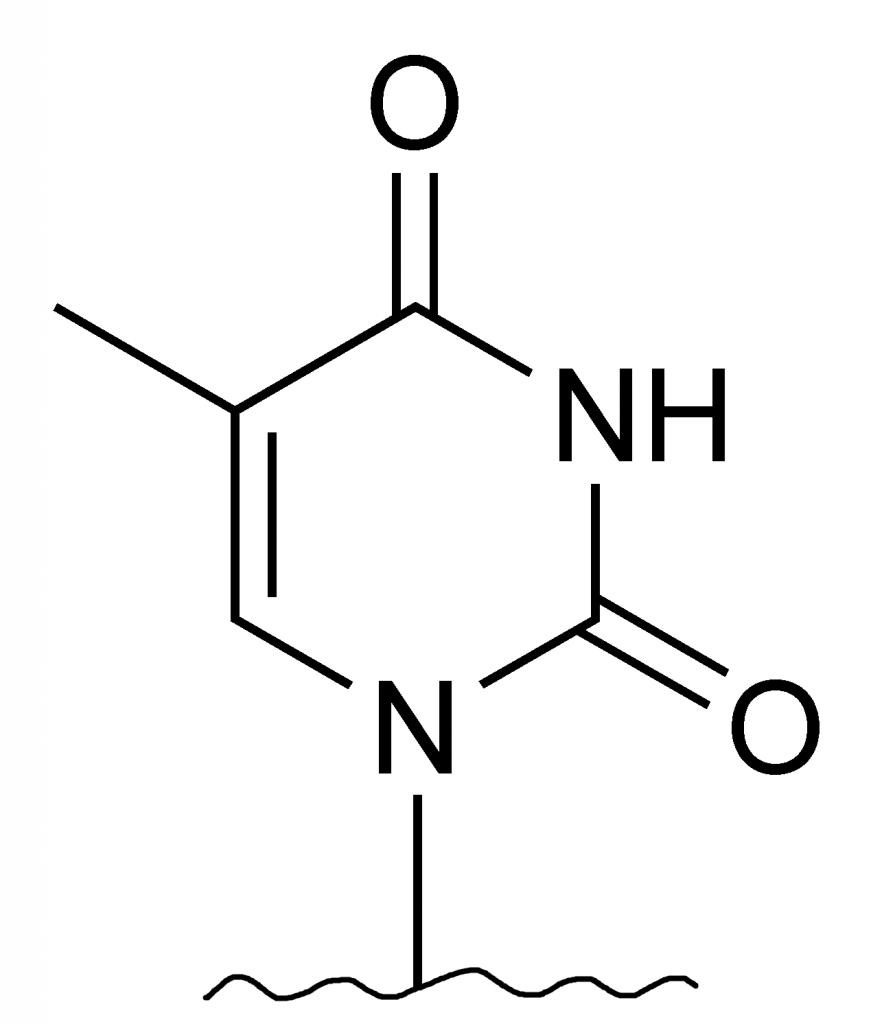
 , même si ça n'est pas vraiment correct (ou plutôt réaliste). Enfin, j'ajouterai qu'il est quand même possible de la bloquer sous cette forme en silylant les O (remplaçant les OH par des OTMS).
, même si ça n'est pas vraiment correct (ou plutôt réaliste). Enfin, j'ajouterai qu'il est quand même possible de la bloquer sous cette forme en silylant les O (remplaçant les OH par des OTMS).

