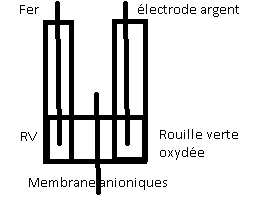
Bonjour, j'aurais besoin de votre aide pour m'aider à comprendre une manipulation que j'ai effectué :
Je vous explique ce qu'il en est, j'ai réalisé à l'aide de membrane échangeuse d'anions une pile électrochimique avec d'un côté de la rouille verte et de l'autre de la rouille verte oxydée qui sont tout les deux des composées à base de fer ( FeII et FeIII pour la rouille verte et FeIII pour la rouille verte oxydée)
J'ai testé cette pile électrochimique avec différentes électrodes , pour faire fonctionner cette pile il faudrait normalement former des couples électrochimiques de Fe/FeII(ouFeIII) , cependant en utilisant d'autre électrode, je me suis rendu compte que la tension aux bornes de la pile était plus élevé avec du fer avec la rouille verte et du cuivre ou de l'argent dans la rouille verte oxydée , c'est ici que je ne comprend pas, comment peut-on avoir une tension avec une électrode en argent ou cuivre alors que la rouille verte oxydée ne contient pas d'ion Ag+ ou Cu2+
Je ne sais pas si ce que je dis est très claire, si ce n'est pas le cas dites le moi, car je bloque vraiment là-dessus ..
-----