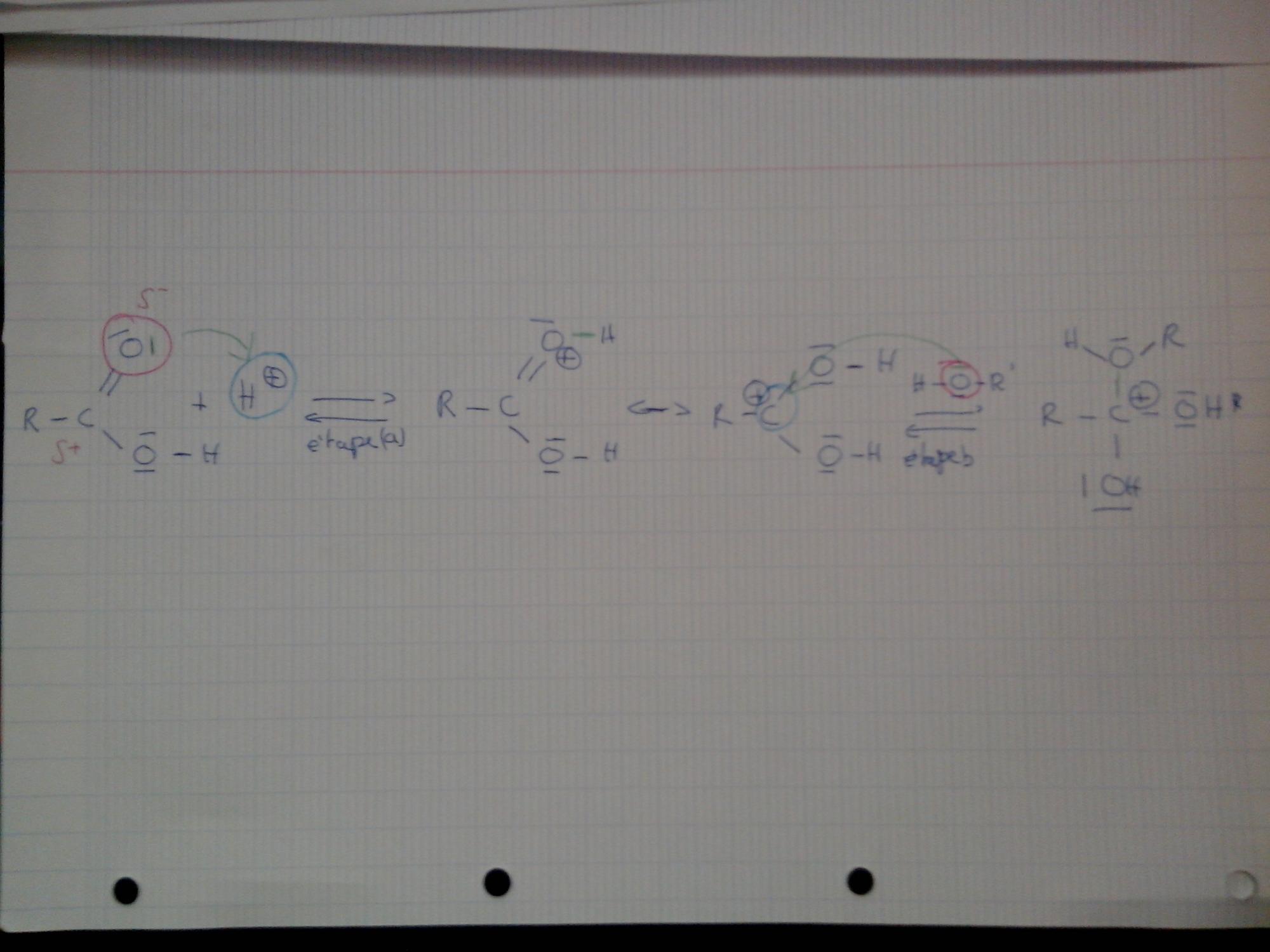
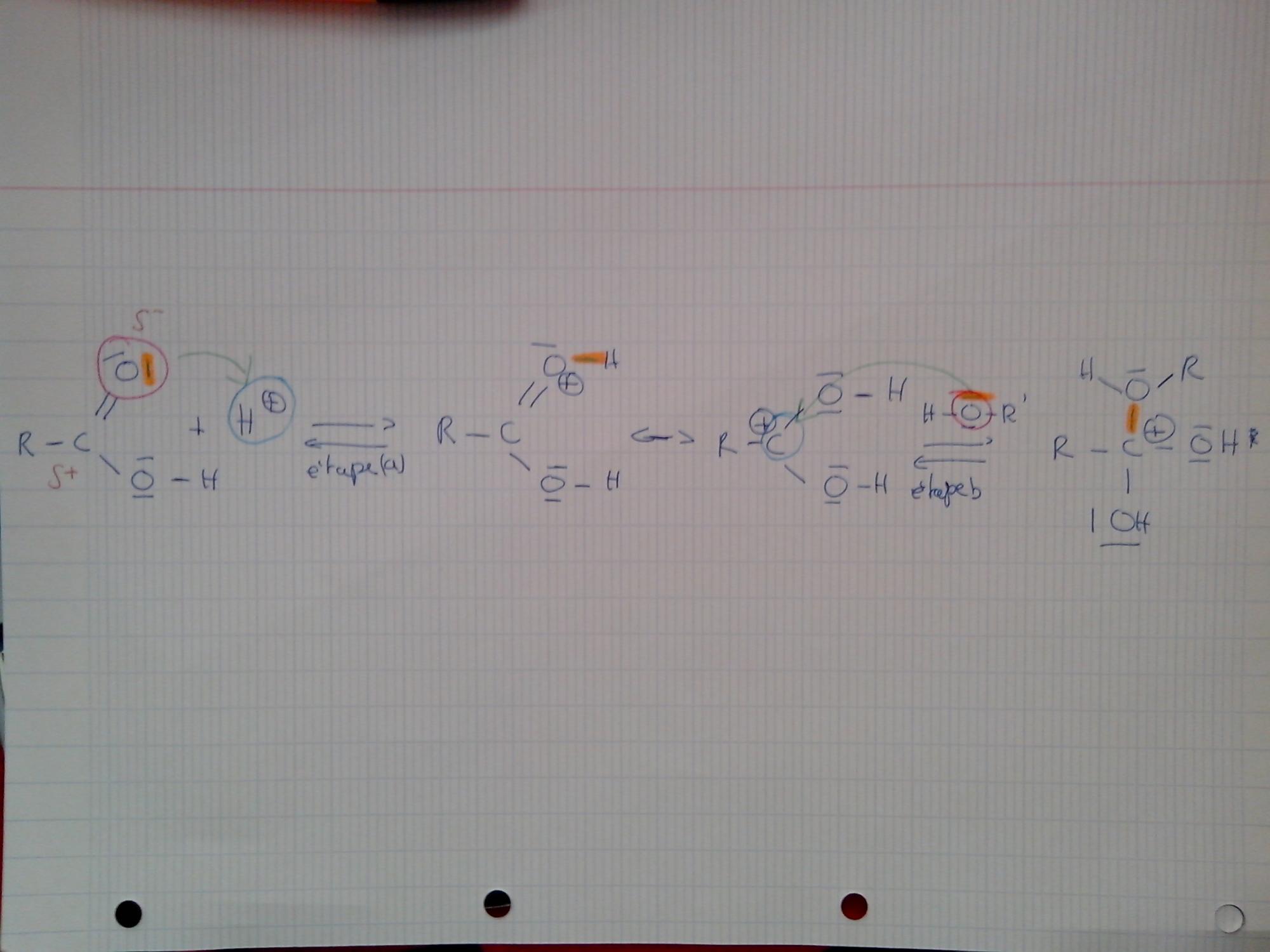
Bonsoir,
Pouvez-vous svp me corriger cet exercice de chimie niveau TS
1. Etude de la molécule de benzocaine.
Question 1
Recopier la formule ci dessous, entourer et nommer les groupes caractéristiques.
Question 2:
Le nom systèmatique de la benzocaine est le 4-aminobenzoate d'éthyle. Donner les arguments qui justifient le nom de cette molécule.
Ce que j'ai fais:
Question 1: confère l'image en bas
question 2: il y'a un éthyle car il y'a CH2- CH3
oate car il y'a un ester
amino car il y'a un amine
le 4 et benz, je ne sais pas d'ou il sortent
Merci d'avance et bonne soirée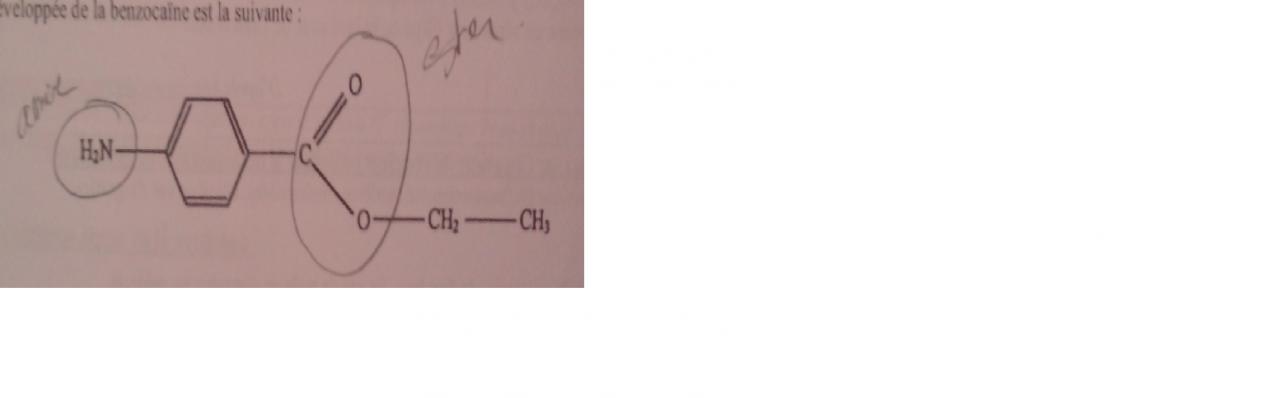
-----





 ) va se fixer sur un site riche en électrons (un site donneur)
) va se fixer sur un site riche en électrons (un site donneur)