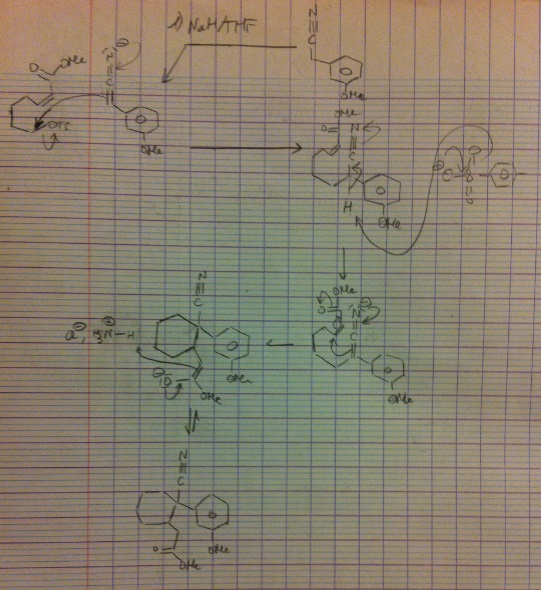
Bonjour,
pourriez-vous m'aider pour cette exercice de synthèse organique s'il vous plaît?
Je bloque pour certaines questions :
- 1.a) après la formation de l'alcène par la réaction de Wittig, je ne vois pas ce que peut faire le K2CO3 dans CH2Cl2 suivi de l'hydrolyse
- 1.b) c'est la réaction de Wittig avec formation de l'alcène E en majoritaire?
- 1.c) les réactifs qui permettraient de passer de 3 à 4 sont : Chlorure de Tosyl dans la pyridine?
- 2.a) je pense la formation de H2 en arrachant le proton en alpha de la fonction nitrile puis l'azote négatif pousse les électrons pour faire une SN2 sur le composé 4 en éliminant le groupement OTs?
- 2.b) l'ajout de soude sur l'ester suffit-il?
- 3.a) est-ce une hydrolyse (?) du nitrile par l'acide sulfurique en amide, ainsi qu'une réaction d'acylation en para à cause du groupement donneur OMe du benzène avec formation d'un intermédiaire de Wheland qui se réaromatise?
Je vous remercie d'avance de votre aide à tous.
-----