hello tout le monde, dans ce composé , si j'ai raison, on peut obtenir 6 formes limites, ce qui implique que la basicité diminue. Mais d'autre part, on peut aussi dire que le methyl va effectuer un effet inductif donneur, ce qui fait que la basicité augmente. Svp ca sera tres gentil vous m'expliquer cette contradiction.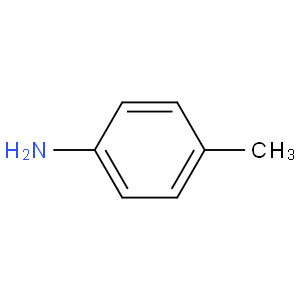
-----