Bonjour à tous,
J'ai un problème concernant la cinétique chimique mais je ne vois pas du tout comment le résoudre. Ci-joint la copie du graphique parce que c'est pas évident à visualiser par écrit.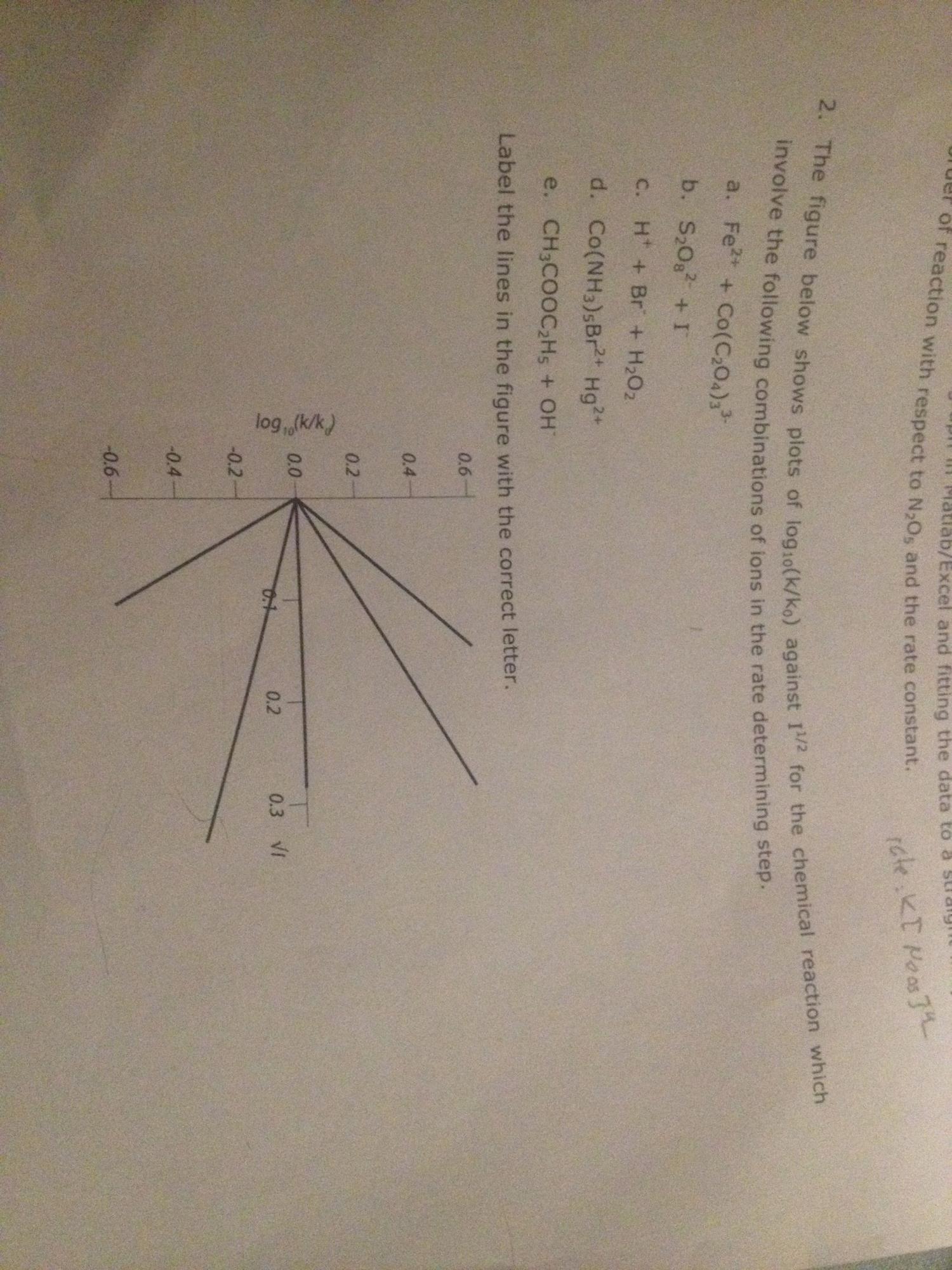
Il m'est donné une liste de réactions chimiques :
a) Fe2+ + Co(C2O4)3 3-
b) (S2O8)2- + I-
c) H+ + Br- + H2O2
d) Co(NH3)5Br2+ + Hg2+
e)CH3COOC2H5 + OH-
et un graphique : log(K/Ko)=f(I^(1/2)) sur lequel se trouve des droites de pentes positives et négatives.
La question est : attribuer a chacunes de ces droites l'équation qui correspond.
Mais je ne vois absolument pas comment faire ... ? `
Quelqu'un aurait-il une idée pour m'éclairer ?
Merci à tous pour votre participation !!!
-----



