Bonjour (ou bonsoir) !
Je rencontre quelques difficultés à résoudre un exercice dont voici l'énoncé:
Soit M, un mélange obtenu par action d'une solution de fer (II) sur une solution de dichromate de potassium K2Cr2O7, en milieu acide sulfurique (pH=0). Les ions dichromate Cr2O72- ont été mis en excès. Avant réaction, la concentration dans M en ions fer(II) est C1 et en ions dichromate C0.
On veut doser l'excès de dichromate de potassium par une solution étalon de sel de MOHR (FeSO4,(NH4)2SO4,6H2O). On utilise comme indicateur d'oxydoréduction l'orthophénantroline ferreuse, appelée aussi ferroïne, qui complexe avec l'ion fer(II) selon l'équilibre de complexation (L=ferroïne): Fe2++3 L = [Fe(L)p]2+.
On dose un volume D=20 mL de M. Le virage de la ferroïne a lieu pour un volume V=12 mL. La concentration en sel de MOHR est C2=3.10-2 mol.L-1.
Calculer la concentration en ions dichromate en excès.
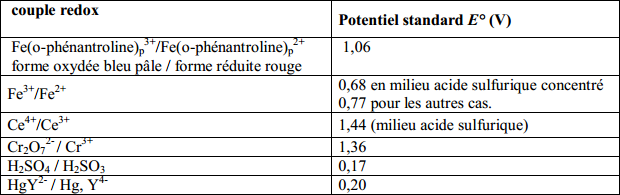
Données (je ne sais pas si elles sont vraiment utiles ici, mais je les mets quand même):
Il est important que je précise qu'il y a dans M, une réaction, que je suppose être (puisqu'il y a deja eu plusieurs questions avec celle-ci dans l'exercice):
9Fe2++Cr2O72-=Cr3++9Fe3++7H2O
Ainsi les données du dosage me permettent de retrouver la concentration en ions fer(III) de M (avec l'équation C1V1=C2V2) mais je ne vois pas comment je peux retrouver à partir de là celle en ion dichromate en excès.
Si quelqu'un pouvait m'aider,
Merci beaucoup !
-----